题目内容
2.下列离子方程式的表达正确的是( )| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与硫酸氢钠溶液混合:HCO3-+H+═H2O+CO2↑ | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
分析 A.原子个数不守恒;
B.二者反应生成硫酸钠、水和二氧化碳;
C.原子个数不守恒;
D.二氧化碳过量反应生成碳酸氢钙.
解答 解:A.金属铝溶于氢氧化钠溶液,离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故A错误;
B.NaHCO3溶液与硫酸氢钠溶液混合,离子方程式:HCO3-+H+═H2O+CO2↑,故B正确;
C.过氧化钠与水反应,离子方程式:2Na2O2+4H2O═4Na++4OH-+O2↑,故C错误;
D.Ca(OH)2溶液中通入过量CO2,离子方程式:CO2+OH-═HCO3-,故D错误;
故选:B.
点评 本题考查了离子方程式书写,明确离子反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
10.草酸晶体的组成可表示为H2C2O4•xH2O.实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4•xH2O CO+CO2+(x+1)H2O.下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题.
(1)A装置为加热分解草酸的装置,该装置错误是试管口应向下倾斜,C装置中盛放的试剂是浓硫酸 (填化学式),E装置的作用是安全瓶(或防倒吸).
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯.这4步操作由先到后的顺序为①③④②(填序号).点燃D处酒精灯前必须要进行的操作名称是验纯.
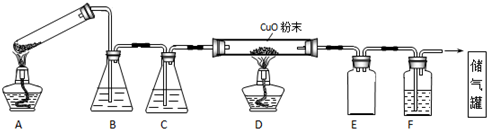
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值.
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL.滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O.
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有100mL容量瓶、胶头滴管.
②x=1.5.
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
则x=2,y=4.能够得出催化剂对该反应有影响结论的实验现象是加入MnSO4固体的试管中溶液褪色速率比未加的快.
(1)A装置为加热分解草酸的装置,该装置错误是试管口应向下倾斜,C装置中盛放的试剂是浓硫酸 (填化学式),E装置的作用是安全瓶(或防倒吸).
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯.这4步操作由先到后的顺序为①③④②(填序号).点燃D处酒精灯前必须要进行的操作名称是验纯.

(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值.
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL.滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+═10CO2+2Mn2++8H2O.
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有100mL容量瓶、胶头滴管.
②x=1.5.
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
| 甲 | 4mL | x mL | 1mL | 无 |
| 乙 | y mL | 2mL | 1mL | 有 |
17.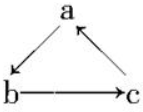 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
 Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如通常所说的“铁三角”、“铝三角”等.如表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | A | B | C | D |
| a | NaOH | Al | Fe | Cu |
| b | Na | Al2O3 | FeCl3 | CuSO4 |
| c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
7.反应H2(g)+Br2(g)?2HBr(g)△H<0,达平衡后,其他条件不变,温度从773K突变到573K时,化学平衡常数K与$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$的关系和平衡移动的方向都正确的是( )
| A. | K>$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向正反应方向移动 | |
| B. | K>$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向逆反应方向移动 | |
| C. | K<$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向正反应方向移动 | |
| D. | K<$\frac{{c}^{2}(HBr)}{c({H}_{2})•c(B{r}_{2})}$,平衡向逆反应方向移动 |
14.有一种测定阿伏加德罗常数的方法需测定NaCl晶体的体积,具体步骤为:准确称出mg NaCl晶体粉末并置于定容仪器a中;用滴定管b向仪器a中滴加某液体c至a仪器的刻度线,即可测出NaCl固体的体积.上述步骤中的a、b、c分别指( )
| A. | 量筒、酸式滴定管、水 | B. | 容量瓶、碱式滴定管、苯 | ||
| C. | 量筒、碱式滴定管、水 | D. | 容量瓶、酸式滴定管、四氯化碳 |
11.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)己知常温下一些电解质的相关数据见下表:
①向等物质的量浓度的Na2C03,CH3COONa,NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-.
②向浓度均为0.010mol/L的NaCl,Na2Cr04组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgN03溶液,首先生成的沉淀其化学式为AgCl.
(3)分别向四份各100mL,浓度均为2mo1L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+,用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红.
(2)己知常温下一些电解质的相关数据见下表:
| H2CO3 | K${\;}_{{a}_{1}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mol/L的NaCl,Na2Cr04组成的混合溶液中逐滴加入浓度为0.010mol•L-1AgN03溶液,首先生成的沉淀其化学式为AgCl.
(3)分别向四份各100mL,浓度均为2mo1L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| I | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)Fe3+、Fe2+、Cu2+.
 如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.