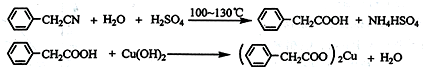题目内容
18.在实验室中,可用KMnO4与浓盐酸反应制取氯气,其反应的化学方程式为2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,关于该反应下列叙述中正确的是( )| A. | 反应中KMnO4被氧化 | |
| B. | 反应中得到电子的物质是Cl2 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 被还原的HCl占参加反应HCl物质的量的3/8 |
分析 2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,以此来解答.
解答 解:A.Mn元素的化合价降低,则反应中KMnO4被还原,故A错误;
B.Cl元素的化合价升高,则HCl发生氧化反应,氯化氢是失电子的物质,而KMnO4中锰的化合价降低是得电子的物质,故B错误;
C.每生成1mol Cl2时,反应中转移的电子为1mol×2×[0-(-1)]=2 mol,故C正确;
D.2molKMnO4作氧化剂得到电子与10molHCl作还原剂失去电子相同,还有6mol的盐酸作为酸,所以被还原的HCl占参加反应HCl物质的量的$\frac{10}{16}$=$\frac{5}{8}$,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法正确的是( )
| A. | 氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,金刚石比石墨稳定 |
9.化学与社会、生活密切相关.下列说法错误的是( )
| A. | 碘酒是指碘单质的乙醇溶液 | |
| B. | 浓硫酸可以刻蚀石英制艺术品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氢氧化铝、小苏打等可用于治疗胃酸过多 |
13.同温同压下,对等体积的气体NH3、CO2、HCl来说,错误的是( )
| A. | 物质的量依次增大 | B. | 分子数相等 | ||
| C. | 质量不相等 | D. | 原子数依次减小 |