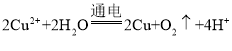题目内容
【题目】下列离子方程式书写正确的是
A.向铁粉中加入足量稀盐酸:Fe+2H+=Fe3++H2↑
B.向FeCl3溶液中加入少量铜粉:Fe3++Cu=Fe2++Cu2+
C.Cu与稀硝酸反应:3Cu+8H++2![]() =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
D.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=![]() +2H2O
+2H2O
【答案】C
【解析】
A.Fe和稀盐酸生成FeCl2,离子方程式为Fe+2H+=Fe2++H2↑,A错误;
B.选项中的离子方程式电荷不守恒,正确的应为2Fe3++Cu=Cu2++2Fe2+,B错误;
C.Cu和稀硝酸反应得到Cu(NO3)2和NO,还有水,选项中的离子方程式正确,C正确;
D.Al(OH)3不溶于过量的氨水,正确的离子方程式应为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,D错误;
答案选C。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
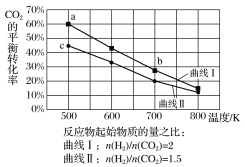
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
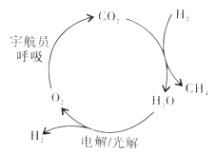
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
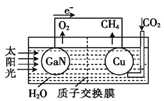
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。
②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
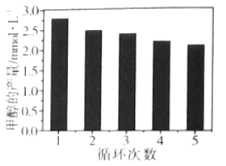
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)