题目内容
K2Cr2O7是一种橙红色具有强氧化性的化合物,当它在酸性条件下被还原成正三价铬时,颜色变为绿色.据此,当交警发现汽车行驶不正常时,就可上前阻拦,并让司机对填充了媳妇有K2Cr2O7的硅胶颗粒的检验装置吹气.若发现硅胶变色达到一定程度,即可证明司机是酒后驾车.这时酒精被氧化为醋酸,其反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
请结合上面的描述回答下列问题:
(1)将上述反应改写为离子方程式: .
(2)如果司机属于醉酒驾车,则检验装置中的硅胶将由 色变为 色.
(3)上述反应中氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 .(本题中的四个空都需填写物质的化学式)
(4)在上述反应中当有69g酒精发生反应时消耗K2Cr2O7的物质的量是 .
2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
请结合上面的描述回答下列问题:
(1)将上述反应改写为离子方程式:
(2)如果司机属于醉酒驾车,则检验装置中的硅胶将由
(3)上述反应中氧化剂是
(4)在上述反应中当有69g酒精发生反应时消耗K2Cr2O7的物质的量是
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)化学反应中只有乙醇、乙酸、水保留化学式;
(2)酸性条件下被还原成正三价铬时,颜色变为绿色;
(3)Cr元素的化合价降低,C元素的化合价升高;
(4)结合反应可知,存在2K2Cr2O7~3CH3CH2OH,以此计算.
(2)酸性条件下被还原成正三价铬时,颜色变为绿色;
(3)Cr元素的化合价降低,C元素的化合价升高;
(4)结合反应可知,存在2K2Cr2O7~3CH3CH2OH,以此计算.
解答:
解:(1)2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O中,乙醇、乙酸、水在离子反应中保留化学式,则对应的离子反应为2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O,故答案为:2Cr2O72-+3CH3CH2OH+16H+=4Cr3++3CH3COOH+11H2O;
(2)司机属于醉酒驾车,发生2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,还原生成正三价铬时,颜色变为绿色,则观察到装置中的硅胶将由橙红色变为绿色,故答案为:橙红;绿;
(3)Cr元素的化合价降低,则K2Cr2O7为氧化剂,得到电子被还原,Cr2(SO4)3 为还原产物;而C元素的化合价升高,则CH3CH2OH为还原剂,失去电子被氧化,则CH3COOH为氧化产物,故答案为:K2Cr2O7;CH3CH2OH;CH3COOH;Cr2(SO4)3;
(4)乙醇的物质的量为
=1.5mol,结合反应可知,存在2K2Cr2O7~3CH3CH2OH,则消耗K2Cr2O7的物质的量是1.5mol×
=1mol,故答案为:1mol.
(2)司机属于醉酒驾车,发生2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,还原生成正三价铬时,颜色变为绿色,则观察到装置中的硅胶将由橙红色变为绿色,故答案为:橙红;绿;
(3)Cr元素的化合价降低,则K2Cr2O7为氧化剂,得到电子被还原,Cr2(SO4)3 为还原产物;而C元素的化合价升高,则CH3CH2OH为还原剂,失去电子被氧化,则CH3COOH为氧化产物,故答案为:K2Cr2O7;CH3CH2OH;CH3COOH;Cr2(SO4)3;
(4)乙醇的物质的量为
| 69g |
| 46g/mol |
| 2 |
| 3 |
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意计算时存在的物质的量关系,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
| A、1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
| B、NH5中既有共价键又有离子键 |
C、NH5的电子式为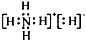 |
| D、它与水反应的离子方程式为NH4++H-+H2O=NH3?H2O+H2↑ |
下列有关环境问题的说法中,不正确的是( )
| A、形成酸雨的主要原因是雨水中溶有CO2 |
| B、氟氯代烷和氮氧化物等会破坏臭氧层 |
| C、CO2、CH4等是造成温室效应的气体 |
| D、白色污染是指废弃塑料制品造成的污染 |
查处酒后驾驶所采用的“便携式乙醇测量仪”以燃料电池为工作原理;在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际上乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+.下列说法正确的是( )
| A、另一电极反应式为:O2+4e-+2H2O=4OH- |
| B、检测时,溶液中的H+向负极移动 |
| C、乙醇在正极发生反应,电子经过外电路流向负极 |
| D、电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
下列做法正确的是( )
| A、金属钠着火时,用大量水进行灭火 |
| B、铝制餐具可代替铁制餐具长时间存放酸性、碱性食物 |
| C、在50mL量筒中配制0.1mol?L-1碳酸钠溶液 |
| D、易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 |
要提取碘水中的碘单质,所选萃取试剂及说法正确的是( )
| A、用酒精后静置则上层颜色加深 |
| B、用汽油二者混溶不分层 |
| C、用CCl4后静置则上层颜色变浅,下层颜色加深 |
| D、用汽油后静置则上层颜色变浅,下层颜色加深 |
某溶液中仅有5种离子,其中含有4n个Na+,2n个K+,n个Cu2+离子,3n个SO42-,则溶液中NO3-的个数为( )
| A、n | B、2n | C、3n | D、4n |
