题目内容
4.NH5属于离子化合物,与水反应的化学方程式为:NH5+H2O=NH3.H2O+H2↑,有关NH5叙述正确的是( )| A. | NH5的电子式: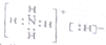 | |
| B. | NH5中N元素的化合价为+5价 | |
| C. | 1molNH5中含有5molN-H键 | |
| D. | 1molNH5与H2O完全反应,转移电子2mol |
分析 NH5属于离子化合物,是由铵根离子与氢负离子通过离子键结合而成,反应NH5+H2O=NH3•H2O+H2↑中NH5的H元素化合价由-1价变为0价、水中H元素化合价由+1价变为0价,所以NH5作还原剂,水作氧化剂,据此解答.
解答 解:A.NH5属于离子化合物,是由铵根离子与氢负离子通过离子键结合而成,电子式为: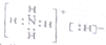 ,故A正确;
,故A正确;
B.NH5中N元素的化合价为-3价,故B错误;
C..NH5是离子化合物氢化铵,所以1molNH5中有4NA个N-H键,故C错误;
D.1 mol NH5与H2O完全反应,转移电子的物质的量=1mol×[0-(-1)]=1mol,故D错误;
故选:A.
点评 本题考查了物质的结构及性质,熟悉离子化合物与共价化合物的区别及氧化还原反应规律是解题关键,注意氨根离子中存在配位键,题目难度不大.

练习册系列答案
相关题目
15.记录片《穹顶之下》再次引起人们对大气质量的强烈关注,化石能源的大量使用是造成大气污染 的主要原因.下列不属于化石能源的是( )
| A. | 煤 | B. | 石油 | C. | 天然气 | D. | 生物质能 |
12.(1)现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验加以鉴别,实验记录如下:
则A、B、C、D的结构简式分别为:ACH3CH2COOH;BCH3CH(OH)CHO;CHCOOCH2CH3;DCH3COOCH3.
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3),取9g乳酸与足量金属Na反应,可生成2.24LH2(标准状况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙脂和1.8g水;乳酸在Cu作催化剂时可被氧化成丙酮酸(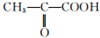 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式是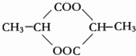 .
.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2悬浊液 | 金属钠 | |
| A | 中和反应 | - | 溶解 | 产生氢气 |
| B | - | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| C | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | - |
| D | 水解反应 | - | - | - |
(2)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3),取9g乳酸与足量金属Na反应,可生成2.24LH2(标准状况),另取同量乳酸与同物质的量的乙醇反应,生成0.1mol乳酸乙脂和1.8g水;乳酸在Cu作催化剂时可被氧化成丙酮酸(
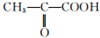 ),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.
),由以上事实推知乳酸的结构简式为CH3CH(OH)COOH.(3)两个乳酸分子在一定条件下脱水生成环酯(C6H8O4),则此环酯的结构简式是
 .
.
19.一定条件下,在密闭容器中进行合成氨反应:N2(g)+3H2(g)?2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是( )
| A. | N2、H2、NH3在容器中共存 | B. | N2、H2、NH3的浓度不改变 | ||
| C. | 反应已达到化学平衡状态 | D. | N2、H2完全转化为NH3 |
9.从金属利用的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序跟下列有关的是:①地壳中的金属元素的含量;②金属活动性;③金属的导电性;④金属冶炼的难易程度;⑤金属的延展性( )
| A. | ①③ | B. | ②④ | C. | ③⑤ | D. | ②⑤ |
16.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 同族上下相邻两种元素的原子序数之差可能为32 |
13.某单烯烃与H2加成后的产物是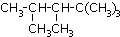 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )
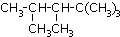 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
14.下列有关说法正确的是( )
| A. | 马口铁(镀锡铁)镀层受损后,铁制品比受损前更容易生锈 | |
| B. | 2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)在高温下能自发进行,则该反应的△H>0 | |
| C. | 恒温恒容密闭容器中进行的反应N2(g)+3H2(g)?2NH3(g);△H=a kJ•mol-1,平衡时向容器中再充入N2和H2,反应速率加快,a值不变 | |
| D. | 氢硫酸(弱酸)中加入少量CuSO4溶液(H2S+CuSO4═CuS↓+H2SO4),H2S的电离程度和溶液的pH均增大 |

 2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积