题目内容
20.在一固定容积为2L的密闭容器中加入2molA和3molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g)?3C(g),2分钟达到平衡,生成1.5mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1mol,体积分数为ω2,请回答下列问题,(1)该反应在30℃时平衡混合气中C的体积分数为ω1=37.5%;
(2)70℃时,若保持温度不变,在2L的密闭容器中加入4molA和6molB,当反应重新达到平衡时,C的体积分数为ω3,则ω3>ω2 (填“>”、“<”或“=”).
(3)可以判断2A(g)+3B(g)?3C(g) 反应已经达到平衡的是BD
A.2v(B)=3v(A) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.混合气体的平均相对分子质量不再改变
E.n(A):n(B):n(C)=2:3:3.
分析 (1)30℃时平衡时C的物质的量为1.5mol,利用差量法计算混合气体减小的物质的量,再计算平衡时混合气体总的物质的量,C的体积分数ω1=$\frac{C的物质的量}{混合气体总物质的量}$×100%;
(2)等效为在70℃到达平衡的基础上压强增大一倍,平衡向正反应方向移动,C的体积分数增大;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.
解答 解:(1)30℃时平衡时C的物质的量为1.5mol,则:
2A(g)+3B(g)?3C(g)物质的量减少△n
3 2
1.5mol 1mol
故平衡时反应混合物总的物质的量为2mol+3mol-1mol=4mol,C的体积分数ω1=$\frac{1.5mol}{4mol}$×100%=37.5%,
故答案为:37.5%;
(2)等效为在70℃到达平衡的基础上压强增大一倍,平衡向正反应方向移动,C的体积分数增大,故ω3>ω2,
故答案为:>;
(3)A.未指明正逆速率,不能说明到达平衡,故A错误;
B.随反应进行,反应混合物的物质的量减小,压强降低,当密闭容器中总压强不变,说明到达平衡,故B正确;
C.混合气体的总质量不变,容器的体积不变,容器中混合气体的密度始终不变,不能说明到达平衡,故C错误;
D.混合气体的总质量不变,随反应进行,反应混合物的物质的量减小,混合气体的平均相对分子质量增大,当混合气体的平均相对分子质量不再改变,说明到达平衡,故D正确;
E.平衡时各组分的物质的量之比不一定等于化学计量数之比,与开始的物质的量及转化率有关,当n(A):n(B):n(C)=2:3:3,不能说明到达平衡,故E错误;
故答案为:BD.
点评 本题考查化学平衡的有关计算、平衡状态的判断等,难度中等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
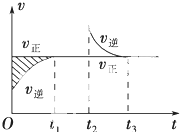 某恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
某恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下均为非气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则 t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
| A. | 用煤液化和气化得到清洁燃料 | B. | 用热碱溶液清除炊具上残留的油污 | ||
| C. | 用氢氟酸来刻蚀玻璃器皿 | D. | 用活性炭去除冰箱中的异味 |
