题目内容
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出.

(l)在组装好装置后,若要检验A-E装置的气密性,其操作是:首先______,______然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好.
(2)装置B中盛放试剂是______
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生______(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式______
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量.若反应前固体质量为16g,反应后称重固体质量减少2.4g.通过计算确定该固体产物的成分是______ (用化学式表示)
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中.写出产生白烟的化学方程式______,迅速产生倒吸的原因是______.
解:(1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好,
故答案为:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰,
故答案为:碱石灰;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡,故还有白色沉淀沉淀,
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:NH3+Cu Cu+N2↑+H2O,
Cu+N2↑+H2O,
故答案为:白色沉淀;NH3+Cu Cu+N2↑+H2O;
Cu+N2↑+H2O;
(4)16gCuO中含有Cu元素质量为16g×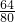 =12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)=
=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)= =0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)=
=0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)= =0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,
=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,
故答案为:Cu2O、Cu;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl,反应方程式为:3Cl2+8NH3=N2+6NH4Cl.盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸,
故答案为:3Cl2+8NH3=N2+6NH4Cl;盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
分析:(1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡;
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水;
(4)生成的红色物质可能为Cu2O、Cu或二者混合物,反应前固体质量为16g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,计算剩余固体中Cu、氧元素质量确定组成,进而计算n(Cu):n(O)确定组成;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl;
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
点评:本题考查氨气的制备与性质实验、对装置的理解、实验操作、化学计算等,难度中等,掌握物质的性质理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.
故答案为:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰,
故答案为:碱石灰;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡,故还有白色沉淀沉淀,
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水,C中发生反应的化学方程式为:NH3+Cu
 Cu+N2↑+H2O,
Cu+N2↑+H2O,故答案为:白色沉淀;NH3+Cu
 Cu+N2↑+H2O;
Cu+N2↑+H2O;(4)16gCuO中含有Cu元素质量为16g×
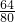 =12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)=
=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,故n(Cu)= =0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)=
=0.2mol,含有O元素的质量为13.6g-12.8g=0.8g,n(O)= =0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,
=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,故剩余固体为Cu2O、Cu,故答案为:Cu2O、Cu;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl,反应方程式为:3Cl2+8NH3=N2+6NH4Cl.盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸,
故答案为:3Cl2+8NH3=N2+6NH4Cl;盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
分析:(1)组装好装置后,若要检验A-E装置的气密性,其操作是:首先关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水后,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好;
(2)进入C中硬质试管的氨气应干燥,装置B的作用是干燥氨气,干燥氨气用碱石灰;
(3)反应后的尾气中含有未反应的氨气,氨气在E溶液中与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡;
装置C中黑色固体逐渐变红,说明有Cu生成,从E中逸出液面的气体可以直接排入空气,说明氨气被氧化为氮气,同时生成水;
(4)生成的红色物质可能为Cu2O、Cu或二者混合物,反应前固体质量为16g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,计算剩余固体中Cu、氧元素质量确定组成,进而计算n(Cu):n(O)确定组成;
(5)氯气有强氧化性,氧化氨气生成N2,产生白烟,说明生成固体,故还生成NH4Cl;
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸.
点评:本题考查氨气的制备与性质实验、对装置的理解、实验操作、化学计算等,难度中等,掌握物质的性质理解原理是解题的关键,是对知识的综合考查,需要学生具有扎实的基础与分析问题、解决问题的能力.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目

 如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分.请回答下列问题:
如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150℃和150~300℃的馏分.请回答下列问题:


 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置

 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置