题目内容
15.下列事实一定能说明HNO2为弱电解质的是( )①常温时NaNO2溶液的pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2与NaCl不能反应
④常温下0.1mol•L-1的HNO2溶液pH=2
⑤1L pH=1的HNO2溶液加水稀释至100L后溶液的pH=2.2
⑥1L pH=1的HNO2溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多.
| A. | ①②③⑥ | B. | ①③④⑤ | C. | ①④⑤⑥ | D. | ②④⑥ |
分析 只有部分电离的电解质为弱电解质,只要能说明亚硝酸部分电离,就能证明亚硝酸是弱电解质,据此分析解答.
解答 解:①常温时NaNO2溶液的pH大于7,说明亚硝酸钠是强碱弱酸盐,亚硝酸根离子水解而使其溶液呈碱性,则亚硝酸部分电离,为弱电解质,故正确;
②用HNO2溶液做导电实验,灯泡很暗,说明溶液中离子浓度较低,但不能水解亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故错误;
③HNO2与NaCl不能反应,说明二者混合不具备复分解反应的条件,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故错误;
④常温下0.1mol•L-1的HNO2溶液pH=2,说明亚硝酸部分电离,为弱电解质,故正确;
⑤1L pH=1的HNO2溶液加水稀释至100L后溶液的pH=2.2,说明亚硝酸中存在电离平衡,所以能证明亚硝酸是弱电解质,故正确;
⑥1L pH=1的HNO2溶液和1L pH=1的盐酸分别与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH多,说明亚硝酸中存在部分电离,所以能证明亚硝酸是弱电解质,故正确;
故选C.
点评 本题考查强弱电解质的判断,为高考高频点,强弱电解质的根本区别是其电离程度,与溶液导电性强弱无关,溶液导电性与离子浓度有关,易错选项是③.

练习册系列答案
相关题目
6.下列物质中,不存在化学键的是( )
| A. | 水 | B. | 食盐 | C. | 氯气 | D. | 氦气 |
3.下列烷烃的命名正确的是( )
| A. | 2-甲基-3-丁烯 | B. | 4-甲基-3-乙基已烷 | ||
| C. | 4-甲基-3-戊醇 | D. | 2,3,3-三甲基戊烷 |
10.鉴定1,3-二氯丙烷中氯元素的存在,下列描述正确的是( )
| A. | 加入NaOH的溶液,加热,冷却后加入AgNO3溶液 | |
| B. | 加入NaOH溶液,加热,冷却后加入足量稀硝酸酸化,再加入AgNO3溶液 | |
| C. | 在氯乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
20.已知瘦肉精的结构式如图,下列关于瘦肉精的说法正确的是( )
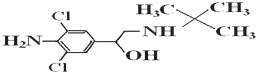

| A. | 摩尔质量为313.5g | |
| B. | 属于芳香烃类化合物 | |
| C. | 瘦肉精的分子式为C12H17Cl2N2O | |
| D. | 可发生加成反应、取代反应、消去反应 |
7.下列关于元素周期表和元素周期律的说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次减小 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点逐渐升高 |
5.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 小苏打是一种膨松剂,可用于制作馒头和面包 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
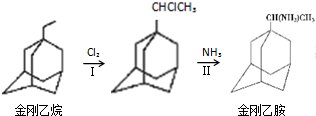
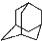 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
 .
. .
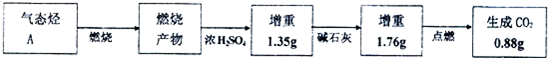
.
 .
.