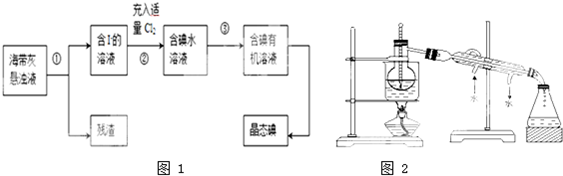
题目内容
标准状况下有①1.8g水;②3.01×1023个氯化氢分子;③4.48L氨气,下列对这三种物质的关系由小到大排列正确的是( )
| A、物质的量:③①② |
| B、氢原子数:①②③ |
| C、原子总数:③②① |
| D、质量:①③② |
考点:阿伏加德罗定律及推论
专题:
分析:根据n=
计算出水的物质的量、根据n=
计算出氯化氢的物质的量、根据n=
计算出氨气的物质的量,然后分别化学式组成分别判断三种物质的物质的量、氢原子数、原子总数大小;最后根据m=nM计算出各物质质量,再判断其质量大小.
| m |
| M |
| N |
| NA |
| V |
| 22.4L/mol |
解答:
解:①1.8g水的物质的量为:
=0.1mol,0.1mol水分子中含有0.2molH原子,总共含有0.3mol原子;
②3.01×1023个氯化氢分子的物质的量为:
=0.5mol,0.5molHCl分子中含有0.5molH原子,总共含有1mol原子;0.5mol氯化氢的质量为:36.5g/mol×0.5mol=18.25g;
③4.48L氨气的物质的量为:
=0.2mol,0.2mol氨气中含有0.6molH原子,总共含有0.8mol原子;0.2mol氨气的质量为:17g/mol×0.2mol=3.4g,
A.按照物质的量由小到大排列为:①③②,故A错误;
B.按照H原子数由小到大排列为:①②③,故B正确;
C.按照原子总数由小到大排列为:①③②,故C错误;
D.按照质量由小到大排列为:①③②,故D正确;
故选BD.
| 1.8g |
| 18g/mol |
②3.01×1023个氯化氢分子的物质的量为:
| 3.01×1023 |
| 6.02×1023 |
③4.48L氨气的物质的量为:
| 4.48L |
| 22.4L/mol |
A.按照物质的量由小到大排列为:①③②,故A错误;
B.按照H原子数由小到大排列为:①②③,故B正确;
C.按照原子总数由小到大排列为:①③②,故C错误;
D.按照质量由小到大排列为:①③②,故D正确;
故选BD.
点评:本题考查了有关物质的量的计算,题目浓度中等,注意掌握物质的量与摩尔质量、阿伏伽德罗常数、气体摩尔体积等物理量之间关系,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列溶液中Cl-浓度最大的是( )
| A、1L0.1mol/LKCl溶液 |
| B、0.2L0.2mol/L的盐酸溶液 |
| C、0.1L0.1mol/L的AlCl3溶液 |
| D、0.3L0.1 mol/L的MgCl2溶液 |
下列反应中生成物总能量高于反应物总能量的是( )
| A、乙醇燃烧 |
| B、氯酸钾分解制氧气 |
| C、铝片和盐酸反应 |
| D、氧化钙溶于水 |
下列说法不正确的是( )
| A、分散质粒子直径介于1~100 nm之间的分散系称为胶体 |
| B、江河入海口三角洲的形成通常与胶体的性质有关 |
| C、用激光笔检验淀粉溶液的丁达尔效应 |
| D、向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
设NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| B、常温下,1 L 0.1 mol?L-1的NH4NO3溶液中NH4+和NO3-总数为0.2 NA |
| C、标准状况下,4.48L重水(D2O)含有的中子数为2 NA |
| D、1mol甲基(-CH3)所含电子数为9NA |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、1mol/LFeCl3溶液中Fe3+数目为NA个 |
| B、2g氢气所含原子数目为NA |
| C、在常温常压下,11.2L氮气所含的原子数目为NA |
| D、17gNH3所含电子数目为10NA |
下列反应的离子方程式正确的是( )
| A、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C、明矾溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
 a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题:
a~e是元素周期表中前四周期元素,请根据表中信息回答下列问题: