��Ŀ����
10��ǿ���ǿ���ϡ��Һ���к��ȿɱ�ʾΪ��H+��aq��+OH-��aq���TH2O��1����H�T-57.3kJ/mol ��֪��CH3COOH��aq��+NaOH��aq���TCH3COONa��aq��+H2O��H�T-Q1kJ/mol
H2SO4��Ũ��+NaOH��aq���TNa2SO4��aq��+H2O��1����H�T-Q2kJ/mol
HNO3��aq��+KOH��aq���TKNO3��aq��+H2O��1����H�T-Q3kJ/mol
������Ӧ��Ϊ��Һ�еķ�Ӧ����Q1��Q2��Q3�ľ���ֵ��С�Ĺ�ϵΪ��������
| A�� | Q1=Q2=Q3 | B�� | Q2��Q1��Q3 | C�� | Q2��Q3��Q1 | D�� | Q2=Q3��Q1 |
���� ϡ��ǿ����ǿ������1molH2O�ų�������Ϊ�к��ȣ�ע��������ʵĵ������Ⱥ�Ũ����ϡ�ͷ��������
��� �⣺ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦ��H+��aq��+OH-��aq��=H2O��H=-57.3kJ/mol��
���ڴ���ĵ������ȣ��ų�������Q1С��57.3kJ����Ũ����ϡ�ͷ��ȣ���Q2��57.3KJ��ϡ����Ϊϡ��ǿ�ᣬQ3=57.3KJ������Q2��Q3��Q1��
��ѡC��
���� ���⿼���к��ȣ���ȷ�к��ȵĸ��������ʵĵ������ȼ��ɽ����Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
18�� A��һ�ֳ����ĵ��ʣ�B��CΪ��ѧ�����Ļ����A��B��C������Ԫ��X����������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ���ǣ�������
A��һ�ֳ����ĵ��ʣ�B��CΪ��ѧ�����Ļ����A��B��C������Ԫ��X����������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ���ǣ�������
 A��һ�ֳ����ĵ��ʣ�B��CΪ��ѧ�����Ļ����A��B��C������Ԫ��X����������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ���ǣ�������
A��һ�ֳ����ĵ��ʣ�B��CΪ��ѧ�����Ļ����A��B��C������Ԫ��X����������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ���������ж���ȷ���ǣ�������| A�� | XԪ�ؿ���ΪAl | B�� | XԪ�ؿ���ΪSi | ||
| C�� | ��Ӧ�ٺ͢ڻ�Ϊ���淴Ӧ | D�� | ��Ӧ�ٺ͢�һ��Ϊ������ԭ��Ӧ |
15������˵����ȷ���ǣ�������
| A�� | ��ϵͳ��������������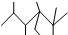 ��������2��3��5��5-�ļ�-4��4-���һ����� ��������2��3��5��5-�ļ�-4��4-���һ����� | |
| B�� | �����ʵ����ı��ͱ�������ȫȼ����������������� | |
| C�� | ���ͼױ���Ϊͬϵ�����ʹKMnO4������Һ��ɫ | |
| D�� | �ṹƬ�� �ĸ߾������ɼӾ۷�Ӧ�γɣ��䵥�����ʽΪC7H60 �ĸ߾������ɼӾ۷�Ӧ�γɣ��䵥�����ʽΪC7H60 |
 ʵ��������ͼװ���Ʊ�����������Ҫ�������£�
ʵ��������ͼװ���Ʊ�����������Ҫ�������£� ��
�� ��Ԫ�����ʻ��ã����ڶ�ĺ�������������Ԫ����-2�ۣ���Ҳ���γ�һ�������������۵Ļ����
��Ԫ�����ʻ��ã����ڶ�ĺ�������������Ԫ����-2�ۣ���Ҳ���γ�һ�������������۵Ļ���� �ϳ�
�ϳ� �������Լ��ͷ�Ӧ��������ȥ��
�������Լ��ͷ�Ӧ��������ȥ�� 
 ��D
��D

 ��
��