题目内容
9.KOH的摩尔质量是56g/mol,16.8gKOH中所含的氧原子数目为0.3NA(用NA表示阿伏加德罗常数),8.8g的二氧化碳在标准状况下的体积是4.48L.分析 氢氧化钾的相对分子质量为56,据此可得出KOH的摩尔质量;根据n=$\frac{m}{M}$、N=nNA计算出16.8gKOH中所含的氧原子数目;根据n=$\frac{m}{M}$、V=nVm计算出8.8g的二氧化碳在标准状况下的体积.
解答 解:KOH的相对分子质量为56,其摩尔质量为56g/mol;16.8gKOH的物质的量为:$\frac{16.8g}{56g/mol}$=0.3mol,0.3molKOH中含有0.3mol氧原子,含有氧原子的数目为0.3NA;
8.8g二氧化碳的物质的量为:$\frac{8.8g}{44g/mol}$=0.2mol,标准状况下0.2mol二氧化碳的体积为:22.4L/mol×0.2mol=4.48L,
故答案为:56g/mol;0.3NA;4.48L.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数之间的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
19.下列化学方程式中,属于水解反应的是( )
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?H2CO3 | D. | HCO3-+H2O?CO32-+H3+O |
14.维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如下:
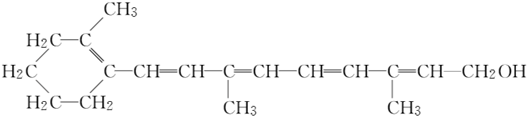
下列有关维生素A1的叙述错误的是( )

下列有关维生素A1的叙述错误的是( )
| A. | 维生素A1中含有两种官能团 | |
| B. | 维生素A1 的分子式为C18H26O | |
| C. | 维生素A1可使酸性高锰酸钾溶液褪色 | |
| D. | 维生素A1分子中含有苯环,1 mol维生素A1最多可与7 mol H2发生加成反应 |
1.下列说法正确的是:
| A. | 无色,透明,稳定的液体都是溶液 | |
| B. | 悬浊液和乳浊液不稳定,可以放置一段时间后分别用过滤和分液的方法分离. | |
| C. | 胶体区别于其它分散系的本质特征是丁达尔现象 | |
| D. | 电泳现象是胶体特有的一种性质 |
 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
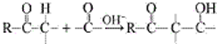
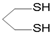 用系统命名法命名,它的名称是1,3-丙二硫醇;
用系统命名法命名,它的名称是1,3-丙二硫醇; 是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸
是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物.
发生酯化反应的产物. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ .
.