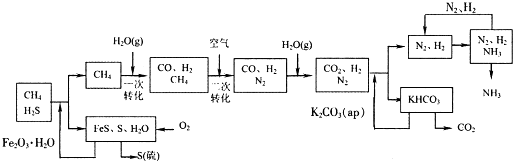
题目内容
在合成氨的生产中,将N2和H2按1∶3的体积比通入合成塔.压强为20 MPa.从合成塔排出的气体中氨气的体积分数为20%,反应前后的温度不变,从合成塔出来的气体压强是多少?
答案:
解析:
解析:
|
答案:从合成塔出来的气体压强是16.7 MPa. 解析:设平衡时消耗N2为x mol N2(g)+3H2(g) 起始/mol 1 3 0 平衡/mol 1-x 3-3x 2x ∴ 反应前:n(1)=1 mol+3 mol=4 mol 平衡时:n(2)=1 mol-0.33 mol+3 mol-3×0.33 mol+2×0.33 mol=3.34 mol 当V、T一定时: |

练习册系列答案
相关题目