题目内容
下列反应对应的离子方程式书写正确的是( )
| A、盐酸与氨水反应 H++OH-═H2O |
| B、硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
| C、硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag |
| D、铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |
考点:离子方程式的书写
专题:
分析:A.盐酸与氨水反应,一水合氨是弱电解质,不能拆成离子;
B.硫酸铜与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化铜沉淀;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.铁与盐酸反应生成亚铁离子,不是生成铁离子.
B.硫酸铜与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化铜沉淀;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.铁与盐酸反应生成亚铁离子,不是生成铁离子.
解答:
解:A.一水合氨不能拆开,正确的离子方程式为H++NH3?H2O=H2O+NH4+,故A错误;
B.硫酸铜溶液中滴加氢氧化钡溶液,反应生成硫酸钡和氢氧化铜沉淀,反应的离子方程式为Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓,故B正确;
C.离子方程式必须满足电荷守恒,正确的离子方程式为2Ag++Cu═Cu2++2Ag,故C错误;
D.铁与稀盐酸反应生成氯化亚铁和氢气,正确的离子方程式为Fe+2H+═Fe2++H2↑,故D错误;
故选B.
B.硫酸铜溶液中滴加氢氧化钡溶液,反应生成硫酸钡和氢氧化铜沉淀,反应的离子方程式为Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓,故B正确;
C.离子方程式必须满足电荷守恒,正确的离子方程式为2Ag++Cu═Cu2++2Ag,故C错误;
D.铁与稀盐酸反应生成氯化亚铁和氢气,正确的离子方程式为Fe+2H+═Fe2++H2↑,故D错误;
故选B.
点评:本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
| A、①②③④⑤ | B、②③④⑤ |
| C、①③④ | D、①②③④ |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 mol 甲醇中含有C-H键的数目为4NA |
| B、0.1mol 丙烯酸中含有双键的数目为0.1NA |
| C、标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA |
| D、常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
胶体区别于与其它分散系的本质特征是( )
| A、胶体粒子直径在1-100nm之间 |
| B、均一、稳定、透明 |
| C、有丁达尔效应 |
| D、胶体分散质能透过滤纸 |
下列有关物质的表达式不正确的是( )
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、-OH(羟基)的电子式为: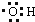 |
实验室用固态不纯氯化钠(含少量泥沙和Na2SO4杂质)制取纯净氯化钠溶液.下列操作可供选用:①逐滴加入稀盐酸至稍过量;②煮沸;③加蒸馏水溶解;④过滤 ⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液.上述实验操作的正确顺序应是( )
| A、①②③④⑤⑥ |
| B、④③⑥⑤①② |
| C、③⑥⑤④①② |
| D、③⑥⑤①④② |
 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题: