题目内容
【题目】水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的几种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验:
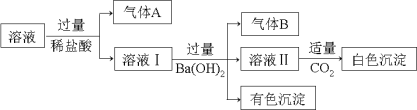
下列判断正确的是
A.气体A一定是CO2,气体B一定是NH3
B.白色沉淀不可能是Al(OH)3
C.溶液中一定存在Al3+、Fe2+、NO3-、NH4+
D.溶液中一定不存在大量Na+
【答案】BD
【解析】
根据题给信息,反应生成有色沉淀,故一定有Fe2+,则溶液中不含有CO32-,加入盐酸反应放出气体,则一定含有NO3-,气体A为NO。加入过量氢氧化钡,产生气体B,说明溶液中含有NH4+;溶液Ⅱ呈碱性,白色沉淀可能为氢氧化铝、碳酸钡等。溶液中存在的各离子具有相同的物质的量,根据现象可知存在NH4+、Fe2+、NO3-,不存在CO32-,再根据正负电荷守恒,溶液中一定存在SO42-,此时n(NH4+)=n(NO3-),n(Fe2+)=n(SO42-),溶液恰好呈电中性,故一定不存在大量的Al3+,则白色沉淀为碳酸钡。
A. 根据上述分析知,气体A为NO,A项错误;
B. 根据上述分析知,白色沉淀为碳酸钡,B项正确;
C. 根据分析溶液中一定不存在Al3+,C项错误;
D. 根据电荷守恒,且各离子的物质的量相同,溶液中一定不含Na+,D项正确;
答案选BD。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
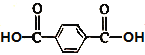
学练快车道口算心算速算天天练系列答案【题目】乙二酸俗称草酸,是一种二元弱酸(结构简式为HOOC﹣COOH,可简写为H2C2O4),它是一种重要的化工原料。(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示)填空:
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
(1)写出H2C2O4的电离方程式_____________
(2)KHC2O4溶液显酸性的原因是___________
(3)向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是________。
A.c(K+)═ c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)
B.c(Na+)═ c(H2C2O4)+c(C2O42﹣)
C.c(K+)+c(Na+)═ c(HC2O4﹣)+c(C2O42﹣)
D.c(K+)>c(Na+)