题目内容
4.铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多重要的化合物及其化学反应.如铁与水反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)△H
(1)上述反应的平衡常数表达式K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$.
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
则△H=-150.8kJ•mol-1.
(3)在t℃时,该反应的平衡常数K=16,在2L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是BC (填编号)
A.若容器压强恒定,则反应达到平衡状态
B.若容器内气体密度恒定,则反应达到平衡状态
C.甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D.增加Fe3O4就能提高H2O的转化率
(4)若将(3)中装置改为恒容绝热(不与外界交换能量)装置,按下表充入起始物质,起始时与平衡后的各物质的量见表:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
根据盖斯定律,①-②×②可得:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),则△H=△H1-2△H2;
(3)①t℃时,反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的平衡常数K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$=16,则平衡时c(H2)=2c(H2O),根据H原子守恒,平衡时n(H2)+n(H2O)=2mol,联立计算解答;
②A.反应前后气体物质的量不变,恒温恒容下,压强始终不变;
B.随反应进行混合气体质量减小,容器的容积不变,容器内气体密度减小,当容器内气体密度恒定,说明到达平衡;
C.由①可知平衡时甲中水的转化率,根据①分析计算乙平衡时水的转化率;
D.增加Fe3O4不影响平衡移动;
(4)若温度相同,A、B、C三种状态下,均等效为增大压强,与原平衡为等效平衡,平衡时氢气体积分数相同.由(1)可知该反应正反应为放热反应,恒容绝热条件下,随反应进行温度发生变化.
由于反应前后气体体积相等,所以C状态下,平衡不移动,氢气的体积分数与原平衡相同;
A状态下,反应正向进行生成氢气,反应放出热量使容器温度升高,抑制反应继续生成氢气;
B状况下,反应逆向进行生成Fe和水,逆向过程吸热,使容器温度降低,抑制反应继续消耗氢气.
解答 解:(1)反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的平衡常数K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$,
故答案为:$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$;
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)△H1=-1118.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(g)△H2=-483.8kJ•mol-1
③2H2(g)+O2(g)=2H2O(l)△H3=-571.8kJ•mol-1
根据盖斯定律,①-②×②可得:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),则△H=△H1-2△H2=-1118.4kJ•mol-1-2×(-483.8kJ•mol-1)=-150.8kJ•mol-1,
故答案为:-150.8kJ•mol-1;
(3)①t℃时,反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的平衡常数K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$=16,则平衡时c(H2)=2c(H2O),故平衡时n(H2)=2n(H2O),根据H原子守恒,平衡时n(H2)+n(H2O)=2mol,则平衡时n(H2O)=$\frac{2}{3}$mol,则H2O的转化率为$\frac{1mol-\frac{2}{3}mol}{1mol}$×100%=33.3%,
故答案为:33.3%;
②A.反应前后气体物质的量不变,恒温恒容下,压强始终不变,故A错误;
B.随反应进行混合气体质量减小,容器的容积不变,容器内气体密度减小,当容器内气体密度恒定,说明到达平衡,故B正确;
C.由①可知平衡时甲中水的转化率为33.3%,乙平衡时c(H2)=2c(H2O),故平衡时n(H2)=2n(H2O),根据H原子守恒,平衡时n(H2)+n(H2O)=2.5mol,则平衡时n(H2O)=$\frac{5}{6}$mol,则H2O的转化率为$\frac{1.5mol-\frac{5}{6}mol}{1.5mol}$×100%=44.4%,故C正确;
D.增加Fe3O4不影响平衡移动,水的转化率不变,故D错误,
故选:BC;
(4)若温度相同,A、B、C三种状态下,均等效为增大压强,与原平衡为等效平衡,平衡时氢气体积分数相同.由(1)可知该反应正反应为放热反应,恒容绝热条件下,随反应进行温度发生变化.
由于反应前后气体体积相等,所以C状态下,平衡不移动,氢气的体积分数与原平衡相同;
A状态下,反应正向进行生成氢气,反应放出热量使容器温度升高,抑制反应继续生成氢气,故氢气体积分数:A<C;
B状况下,反应逆向进行生成Fe和水,逆向过程吸热,使容器温度降低,抑制反应继续消耗氢气,故氢气体积分数:B>C,
则氢气体积分数:B>C>A,
故答案为:B>C>A.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、盖斯定律应用、平衡状态的判断等,题目综合性较强,难度较大,侧重考查学生对知识的综合运用能力.

| A. | 强酸跟强碱的反应热一定是中和热 | |
| B. | 1molC完全燃烧放热383.3kJ,其热化学方程为:C+O2═CO2 △H=-383.3kJ•mol-1 | |
| C. | 在稀溶液中,酸与碱发生中和反应生成1mol H2O时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为:H+(aq)+OH-(aq)═H2O(l);△H=57.3KJ•mol-1 |
| A. | 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol-1 | |
| B. | 12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ•mol-1 | |
| C. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286 kJ•mol-1, 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol-1 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 |
| A. | 沸腾炉 | B. | 吸收塔 | C. | 高炉 | D. | 接触室 |
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).
写出该电池的负极反应式:CO+4OH--2e-=CO32-+2H2O.
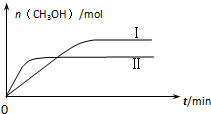
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图.
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”).
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有6个H-H断裂.
| 选项 | 实验事实 | 解释或结论 |
| A | 已知C(石墨,s)=C(金刚石,s)△H>0 | 金刚石比石墨稳定 |
| B | 2N2O5(g)═4NO2(g)+O2(g)△H>0 该反应在室温下可以自发进行 | 这是一个熵增反应 |
| C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
| D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |
