题目内容
下列叙述正确的是
A.Na2O与Na2O2都是碱性氧化物
B.生石灰能与水反应,可用来干燥氨气
C.从海水中提取物质都必须通过化学反应才能实观
D.氯化铝是一种离子型电解质.可用于电解法制铝
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)请配平以下化学方程式:
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为___________L。
(2)25℃时,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为_____________。
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=_________。
0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。

(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |


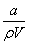 ×100%
×100%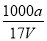 mol·L-1
mol·L-1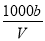 mol·L-1
mol·L-1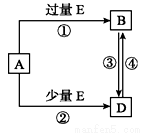

 通入空气不能过量,原因是______________________。
通入空气不能过量,原因是______________________。

 O-+H2O+CO2=CaCO3↓+2HClO
O-+H2O+CO2=CaCO3↓+2HClO