题目内容
5.在无机化工中,硫酸亚铁铵[(NH4)2Fe(SO4)2]是制取其他铁系化合物的原料,如制取氧化铁系颜料、磁性材料和黄血盐等.某化学兴趣小组设计如下实验方案,探究(NH4)2Fe(SO4)2完全分解的产物.试回答以下问题:已知:
I.固体(NH4)2Fe(SO4)2隔绝空气受热完全分解是氧化还原反应.
Ⅱ.98%浓硫酸能顺利吸收SO3.
(1)甲同学设计以下流程探究分解的部分产物.

①B装置预期的现象是变蓝,C装置的作用可能是吸收NH3或SO3,D装置可以检验分解产物中是否含有SO2.
②加热前先通一会N2,再关闭气阀,其目的是排出装置中的空气.
(2)乙同学猜想(NH4)2Fe(SO4)2分解时可能生成了SO3,小组同学设计如图装置进行验证.
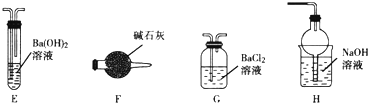
①不能选择E和F装置的原因是E和F装置都能吸收SO3和SO2.
②加热样品A,然后依次连接G与H并进行实验,请你提出需要改进的方案:在样品加热装置与G之间增加防倒吸的装置.
③已知饱和SO2水溶液中c(SO32-)=6.0×10-8mol•L-1,Ksp(BaSO4)=5.4×10-7.通过计算判断在1.0mol•L-1的BaCl2溶液中,通入足量纯净的SO2能否生成BaSO3沉淀?Q=1.0×6.0×10-8=6.0×10-8<Ksp(BaSO3),所以不能生成BaSO3沉淀.
④当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是NH3和SO2同时通入BaCl2溶液中,能生成BaSO3白色沉淀.为了进一步证明是否有SO3生成,请你补充实验方案(不要求写具体的操作过程):取白色沉淀于试管中,滴加过量的稀盐酸,若白色沉淀不溶解或部分溶解,则有SO3生成,若白色沉淀完全溶解,则没有SO3生成.
分析 (1)①晶体分解生成的产物中含水蒸气,B装置中无水硫酸铜遇到水蒸气会反应生成硫酸铜晶体呈蓝色,C装置是浓硫酸用来吸收碱性气体氨气或生成的三氧化硫,便于装置D利用品红溶液检验二氧化硫的存在;
②加热前先通一会儿N2,排净装置内的空气防止空气成分干扰气体检验;
(2)①生成产物制得三氧化硫、二氧化硫都是酸性氧化物和碱发生反应;
②生成的气体中含氨气、二氧化硫、三氧化硫等易溶于水的气体容易发生倒吸;
③根据溶液中Q与Ksp的关系分析;
④分解产物中当氨气和二氧化硫通入氯化钡溶液中互生成亚硫酸钡白色沉淀,检验三氧化硫可以检验生成的白色沉淀是否溶于盐酸.
解答 解:(1)①晶体分解生成的产物中含水蒸气,无水硫酸铜遇到水蒸气会反应生成硫酸铜晶体呈蓝色,B装置中预期现象是白色硫酸铜变蓝色,C装置是浓硫酸用来吸收可能分解生成的碱性气体氨气或生成的三氧化硫,便于装置D利用品红溶液检验二氧化硫的存在,二氧化硫具有漂白性,可以使品红溶液褪色,
故答案为:变蓝;吸收NH3或SO3;SO2;
②加热前先通一会儿N2,再关闭气阀,其目的是利用氮气吧装置中空气全部赶出,防止空气中的水蒸气等干扰生成气体的检验,
故答案为:排出装置中的空气;
(2)①不能选择E和F装置的原因是,装置中的氢氧化钡溶液是强碱溶液,碱石灰是氢氧化钠和氧化钙都可以和产物中的三氧化硫和二氧化硫气体,
故答案为:E和F装置都能吸收SO3和SO2;
②加热装置与G、H连接并进行实验,生成的气体中含氨气、二氧化硫、三氧化硫等易溶于水的气体容易发生倒吸,需要改进的方案是在样品加热装置与G之间增加防倒吸的装置,
故答案为:在样品加热装置与G之间增加防倒吸的装置;
③若溶液中c(Ba2+)=1 mol•L-1,c(SO32-)=6.0×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)=1×6.0×10-8=6.0×10-8<Ksp(BaSO3)=5.4×10-7,故不能析出BaSO3沉淀,
故答案为:Q=1.0×6.0×10-8=6.0×10-8<Ksp(BaSO3),所以不能生成BaSO3沉淀;
④当G中出现大量白色沉淀时,并不能说明A中生成了SO3,理由是NH3和SO2同时通入BaCl2溶液中,能生成BaSO3白色沉淀,为了进一步证明是否有SO3生成,请你补充实验方案是:取白色沉淀于试管中,滴加过量的稀盐酸,若白色沉淀不溶解或部分溶解,则有SO3生成,若白色沉淀完全溶解,则没有SO3生成,
故答案为:NH3和SO2同时通入BaCl2溶液中,能生成BaSO3白色沉淀;取白色沉淀于试管中,滴加过量的稀盐酸,若白色沉淀不溶解或部分溶解,则有SO3生成,若白色沉淀完全溶解,则没有SO3生成.
点评 本题考查物质分解产物的实验测定和实验检验方法分析判断,主要是气体性质、气体检验设计、溶度积应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础与灵活应用能力,题目难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 溶液. | 说法A不正确 |
【查阅文献】
Ⅰ.苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
| 序号 | 实验步骤 | 现象 | 结论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释.
| A. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 24g二氧化硅晶体中含有SiO2分子数为0.4NA | |
| D. | 5.6g Fe与含0.2mol HNO3的溶液充分反应,至少失去电子数为0.2NA |
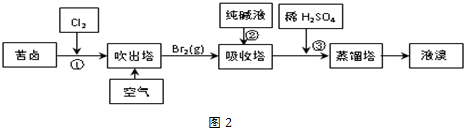
(1)以海水为原料生产海盐过程中产生苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子).从苦卤中可提取溴,其生产流程如下:
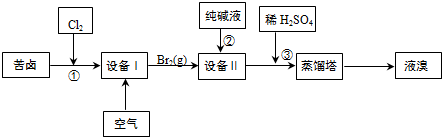
①在设备Ⅰ中用空气吹出Br2,并在设备Ⅱ中用纯碱溶液吸收,发生反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑,若吸收1mol Br2,转移的电子数为$\frac{5}{3}$mol.
②所用的设备名称为(填序号):设备ⅠB设备ⅡA
A.吸收塔 B.吹出塔 C.分馏塔 D.压滤机
③步骤③中发生反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O.
④蒸馏塔中蒸馏温度控制在90℃左右的原因是顺利将溴蒸出,同时防止水馏出.
(2)从海水中提取镁的工艺流程如下:
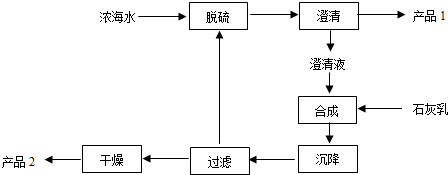
浓海水中的离子浓度如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(3)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号)
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺.
| A. | Ca(HCO3)2与NaOH溶液反应 | B. | Ca(HCO3)2与澄清石灰水反应 | ||
| C. | NaHCO3与澄清石灰水反应 | D. | NH4HCO3与澄清石灰水反应 |
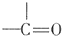 $→_{H_{2}O}^{RNH_{2}}$
$→_{H_{2}O}^{RNH_{2}}$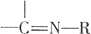
 .
.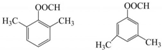 .
.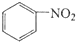 $\stackrel{Fe/HCl}{→}$
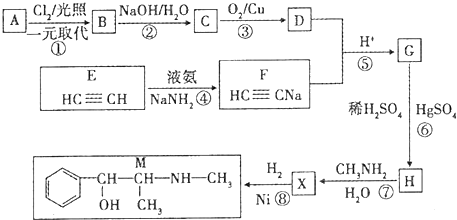
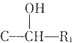
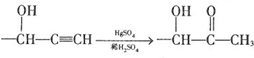
$\stackrel{Fe/HCl}{→}$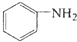 参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体
参照上述路线,设计以苯、乙醛为主要原料合成某药物中间体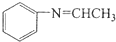 的路线
的路线 .
.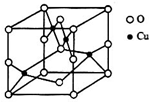 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问题: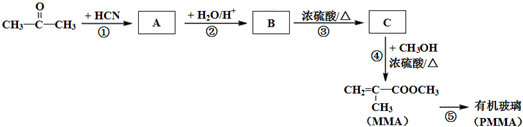
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$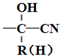
 .
. .
.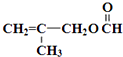
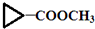
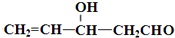
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.