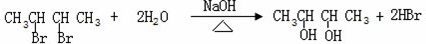题目内容
一定温度下,0.1mol×L-1醋酸溶液加水或加入少量CH3COONa晶体,发生的变化正确的是( )
A B C D
加H2O 氢离子浓度增大 氢离子浓度减少 导电能力降低 导电能力增强
加CH3COOHa 氢离子浓度减小 氢离子浓度减小 导电能力增强 导电能力降低
答案:BC
解析:
解析:
醋酸溶液中存在如下电离平衡: CH3COOHƒCH3COO-+H+ 醋酸的稀溶液进行稀释时,尽管能促进电离,但H+离子的浓度反而减小,故可知已知溶液的导电能力也减小。若加CH3COONa晶体,对溶液的体积影响不大,但却增大了溶液中CH3COO-的浓度,根据平衡移动原理,电离平衡将向左移动,即加入CH3COO-后抑制了醋酸的电离,即引起H+浓度减小,但由于平衡的移动不能抵消加入的CH3COO-数量,故新平衡时CH3COO-的浓度比原平衡时大,何况同时还引入了Na+呢,故导电能力增强了。综上,该题应选B、C。
|

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案
相关题目