题目内容
10.下列说法正确的是( )| A. | 摩尔质量就等于物质的式量 | |
| B. | 摩尔质量就是物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
分析 A.摩尔质量是单位物质的量的物质的质量,摩尔质量的单位是g/mol,式量的单位是“1”;
B.在数值上摩尔质量就等于物质的式量;
C.摩尔质量的单位是g/mol;
D.根据硫酸和磷酸相对分子质量判断;
解答 解:A、摩尔质量的单位是g/mol,式量的单位是“1”,在数值上物质的摩尔质量等于其式量,故A错误;
B.在数值上物质的摩尔质量等于其式量,故B错误;
C.硝酸的摩尔质量是63g/mol,故C错误;
D.在数值上物质的摩尔质量等于其式量,硫酸和磷酸的相对分子质量都是98,所以硫酸和磷酸的摩尔质量相等都是98g/mol,故D正确.
点评 本题考查了有关摩尔质量的有关问题,难度不大,明确在数值上物质的摩尔质量等于其式量.

练习册系列答案
相关题目
8.已知锶与钙同族,下列对锶及其化合物的叙述正确的是( )
| A. | 碳酸锶难溶于水 | B. | 氢氧化锶的碱性比氢氧化钙弱 | ||
| C. | 单质锶跟冷水不反应 | D. | 锶是第四周期元素 |
9.已知某溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-、MnO4-中的若干种离子组成.某化学兴趣小组通过下列实验确定了其组成.
(1)根据下列实验步骤和现象,推断实验结论:
(2)上述实验步骤Ⅳ中开始阶段发生反应的离子方程式一定有2HCO3-+Ba2++2OH=BaCO3↓+2H2O+CO32-.
 (3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.
Y可能为HCl或HNO3,B的组成为BaCO3、BaSO4且$\frac{n(BaS{O}_{4})}{n(BaC{O}_{3})}$=$\frac{2}{3}$.
(4)已知氧氧化铝电离出H+比碳酸氢钠电离出H+更难.根据上述推断,取少量原溶液于试管中,向试管中滴加少量硫酸氢钠稀溶液至过量,按先后顺序可以观察到的现象有先是生成白色沉淀,然后产生气泡,最后沉淀溶解.写出最后发生反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
(1)根据下列实验步骤和现象,推断实验结论:
| 实验步骤与实验现象 | 实验结论 |
| Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是Cu2+、MnO4-、Fe2+ |
| Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是Mg2+、Ag+、Ba2+、Al3+、I-、SiO32-,一定含有的离子是CO32-、K+ |
| Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是AlO2-,生成沉淀A的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
| Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有BaCO3,可能含有BaSO4 |
 (3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.Y可能为HCl或HNO3,B的组成为BaCO3、BaSO4且$\frac{n(BaS{O}_{4})}{n(BaC{O}_{3})}$=$\frac{2}{3}$.
(4)已知氧氧化铝电离出H+比碳酸氢钠电离出H+更难.根据上述推断,取少量原溶液于试管中,向试管中滴加少量硫酸氢钠稀溶液至过量,按先后顺序可以观察到的现象有先是生成白色沉淀,然后产生气泡,最后沉淀溶解.写出最后发生反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
6.下列变化过程中,需要加入还原剂才能实现的是( )
| A. | MnO2→MnO4- | B. | A1O2-→Al(OH)3 | C. | AsO33-→AsO43- | D. | MnO2→MnCl2 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L NaOH 溶液:K+,Na+,SO42-,CO32- | |
| B. | 0.1mol/L Na2CO3溶液:K+,Ba2+,NO3-,Cl- | |
| C. | 0.1mol/L FeCl3溶液:K+、H+,I-,SCN- | |
| D. | pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
2.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| C. | 18 g H2O含有10NA个质子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
20.据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的化合物(CH4•nH2O).
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是CH4•nH2O=CH4↑+nH2O.
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4 kJ•mol-1.
②CH4不完全燃烧也可制得合成气:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H=-35.4kJ•mol-1,则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为②(填序号).
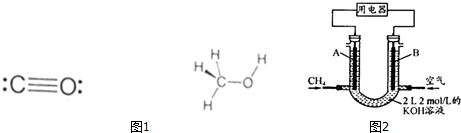
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇(CH3OH),发生的主要反应如下:CO和甲醇的结构式如图1所示:
①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
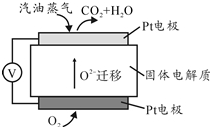
(4)可燃冰中CH4的其它用途是能源和燃料,将CH4设计成燃料电池,其利用率更高,装置示意如图2(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-.
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是CH4•nH2O=CH4↑+nH2O.
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4 kJ•mol-1.
②CH4不完全燃烧也可制得合成气:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H=-35.4kJ•mol-1,则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为②(填序号).
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇(CH3OH),发生的主要反应如下:CO和甲醇的结构式如图1所示:

①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(4)可燃冰中CH4的其它用途是能源和燃料,将CH4设计成燃料电池,其利用率更高,装置示意如图2(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-.
 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$ ,其空间结构为正四面体;乙烯的结构简式为CH2=CH2,乙烯通入溴水中的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,,其反应类型为加成反应,C5H12的烃有3种同分异构体
,其空间结构为正四面体;乙烯的结构简式为CH2=CH2,乙烯通入溴水中的化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,,其反应类型为加成反应,C5H12的烃有3种同分异构体