题目内容
如图所示,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系。对于图中两种物质间的转化,通过一步反应就能实现的有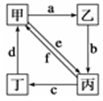
| A.只有a、b、c、d | B.只有b、c、d、e |
| C.只有c、d、e、f | D.a、b、c、d、e、f |
D
解析试题分析:根据题意结合相关物质的性质知,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,甲物质Na2CO3和氢氧化钙反应生成乙物质NaOH;丁物质二氧化碳和氢氧化钠反应生成甲物质碳酸钠,乙物质氢氧化钠和过量二氧化碳反应生成丙物质碳酸氢钠;丙物质碳酸氢钠和酸反应生成丁二氧化碳,甲物质碳酸钠和二氧化碳、水反应生成丙碳酸氢钠;碳酸氢钠分解生成乙物质碳酸钠,所以abcdef都可以一步反应实现转化;选D.
考点:考查钠的化合物。

某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: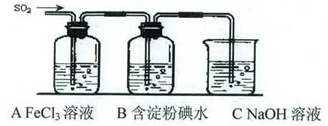
(1)SO2气体还原Fe3+反应的产物是_____________、_____________(填离子符号)。
(2)下列实验方案可以用于在实验室制取所需SO2的是____。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(4)如果有280 mL SO2气体(已折算为标态)进入C装置中,则C中50 mL NaOH溶液的浓度至少为_____________mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(6)能表明I-的还原性弱于SO2的现象是_________________________________________,写出有关离子方程式:_______________________________________。
部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理: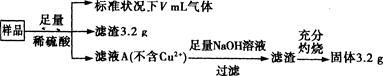
下列说法正确的是 ( )
| A.滤液A中的阳离子为Fe3+、Fe2+、H+ |
| B.V=896 |
| C.样品中CuO的质量为4.0 g |
| D.样品中Fe元素的质量为2.24g |
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
| A.K | B.Na | C.Fe | D.Al |
将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用( )
| A.KSCN溶液和氯水 | B.铁粉和KSCN溶液 |
| C.浓氨水 | D.酸性KMnO4溶液 |
纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是
| A.分别放在炒锅中加热,观察是否有残留物 |
| B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色 |
| C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀 |
| D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
根据上述实验,以下说法正确的是
| A.气体A一定只是NO |
| B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液中含有K2SO3 |
| C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D.溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |
下列物质不能使红墨水褪色的是( )
| A.活性炭 | B.过氧化钠 | C.NaCl溶液 | D.漂白粉 |
