题目内容
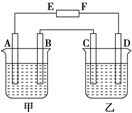 在如图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol?L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
在如图中,E和F分别为电源两极;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.15mol?L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则(1)E为
(2)A极的电极反应式为
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为
(4)甲烧杯中滴入石蕊试液,
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,说明B极生成Ag,应为电解池的阴极,则F为负极,E为正极,C为阳极,D为阴极;
(2)A极与正极相连为阳极,则A极上氢氧根离子失电子;根据电极方程式结合电子守恒计算生成的氧气;
(3)根据电子守恒计算乙中消耗的氯化铜,再求出剩余的氯化铜的浓度;
(4)甲中A极上氢氧根离子失电子,同时生成氢离子,根据电极方程式判断.
(2)A极与正极相连为阳极,则A极上氢氧根离子失电子;根据电极方程式结合电子守恒计算生成的氧气;
(3)根据电子守恒计算乙中消耗的氯化铜,再求出剩余的氯化铜的浓度;
(4)甲中A极上氢氧根离子失电子,同时生成氢离子,根据电极方程式判断.
解答:
解:(1)A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,说明B极生成Ag,应为电解池的阴极,则F为负极,E为正极,C为阳极,D为阴极;
故答案为:正;阳;
(2)A极与正极相连为阳极,则A极上氢氧根离子失电子,A极的电极方程式为:4OH--4e-═2H2O+O2↑;甲中B极的反应为:Ag++e-=Ag,发现B极增重1.08g,则Ag的物质的量为0.01mol,转移电子的物质的量为0.01mol;由4OH--4e-═2H2O+O2↑可知转移电子为0.01mol时生成的氧气为0.0025mol,所以氧气的体积为56ml;
故答案为:4OH--4e-═2H2O+O2↑;56;
(3)D极的反应为Cu2++2e-=Cu,转移电子为0.01mol时,消耗为Cu2+为0.005mol,则剩余的Cu2+为0.10L×0.15mol?L-1-0.005mol=0.01mol,则此时溶液的物质的量浓度将变为
=0.1mol?L-1;
故答案为:0.1;
(4)甲中A极上氢氧根离子失电子,同时生成氢离子,所以A极附近变红;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,其电解方程式为:4AgNO3+2H2O
2Ag+O2↑+4HNO3,所以在甲烧杯中最终得到HNO3溶液;
故答案为:A;HNO3.
故答案为:正;阳;
(2)A极与正极相连为阳极,则A极上氢氧根离子失电子,A极的电极方程式为:4OH--4e-═2H2O+O2↑;甲中B极的反应为:Ag++e-=Ag,发现B极增重1.08g,则Ag的物质的量为0.01mol,转移电子的物质的量为0.01mol;由4OH--4e-═2H2O+O2↑可知转移电子为0.01mol时生成的氧气为0.0025mol,所以氧气的体积为56ml;
故答案为:4OH--4e-═2H2O+O2↑;56;
(3)D极的反应为Cu2++2e-=Cu,转移电子为0.01mol时,消耗为Cu2+为0.005mol,则剩余的Cu2+为0.10L×0.15mol?L-1-0.005mol=0.01mol,则此时溶液的物质的量浓度将变为
| 0.01mol |
| 0.1L |
故答案为:0.1;
(4)甲中A极上氢氧根离子失电子,同时生成氢离子,所以A极附近变红;甲烧杯中盛有100mL 0.2mol?L-1 AgNO3溶液,其电解方程式为:4AgNO3+2H2O
| ||
故答案为:A;HNO3.
点评:本题考查了原电池和电解池原理,根据各个电极上发生的反应再结合转移电子相等来分析解答,题目难度中等.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
下列叙述中,正确的是( )
| A、某物质的名称为3,3-二甲基丁烷 |
| B、CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能在一条直线上 |
| C、某物质的名称为2-乙基-1-丁烯 |
| D、1mol甲基(-CH3)中所含电子数为9mol |
60mL 0.5mol/L的氢氧化钠溶液和40mL 0.4mol/L的硫酸相混合后,溶液的pH约为( )
| A、0.5 | B、1.7 |
| C、2 | D、13.2 |
下列有关化学用语表示正确的是( )
| A、二氧化硅的分子式:SiO2 | ||
B、2-乙基丁烷: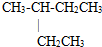 | ||
C、次氯酸的电子式: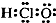 | ||
D、质子数为53,中子数为78的碘原子:
|
下列叙述正确的是( )
| A、同温同压下,相同体积的物质,它们的物质的量必相等 |
| B、任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等 |
| C、1L一氧化碳所体一定比1L氧气质量小 |
| D、等体积、等物质的量浓度的盐酸和醋酸(CH3COOH)中所含的H+数一定相等 |
标准状况下有①6.72L甲烷 ②3.01×1023个氯化氢分子 ③13.6g硫化氢④0.2mol NH3.下列对这四种气体的关系从小到大表示不正确的是( )
| A、体积:④<①<②<③ |
| B、密度:①<④<③<② |
| C、质量:④<①<③<② |
| D、氢原子数:②<④<③<① |