题目内容
14.在一定温度下,密闭容器中A(?)+B(?)═2C(?)类型的反应达到了平衡:(1)当增加或减少A物质时,平衡不移动,则A物质的状态为固体或液体;
(2)升高温度平衡向右移动,此正反应是吸热反应;升高温度时,逆反应速率增大了(填“增大”或“减小”);
(3)若B物质为气态,增大压强时平衡不移动,则A物质为气态物质,C物质为气态物质.
分析 (1)当增加或减少A物质时,平衡不移动,可知A不是固体;
(2)升高温度平衡向右移动,可知正反应为吸热反应,升高温度反应速率加快;
(3)若B物质为气态,增大压强时平衡不移动,可知该反应为气体体积不变的反应.
解答 解:(1)当增加或减少A物质时,平衡不移动,可知A不是固体,则A为固体或液体,故答案为:固体或液体;
(2)升高温度平衡向右移动,可知正反应为吸热反应,升高温度反应速率加快,则逆反应速率增大,故答案为:吸;增大;
(3)若B物质为气态,增大压强时平衡不移动,可知该反应为气体体积不变的反应,则A、C均为其它物质,故答案为:气;气.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意反应中物质的状态、化学计量数关系,题目难度不大.

练习册系列答案
相关题目
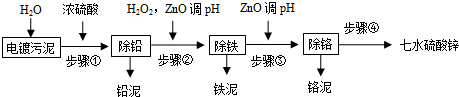
4.电镀污泥中包含大量难以降解的贵重金属离子,如Zn2+、Pb2+、Fe2+、Fe3+、Cr3+、Ca2+等.在回收过程中,如果对其处理不当或者未经处理就进行填埋,将会给环境和社会带来极大的危害.以下是回收流程:
已知:
①各离子开始沉淀和完全沉淀的pH值如下表:
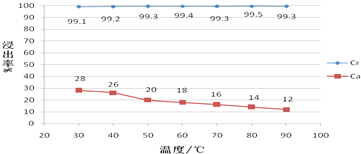
②温度对各离子的浸出率影响如图:
(1)请写出步骤①除铅的离子方程式:Pb2++SO42-=PbSO4↓.
(2)步骤②加入双氧水的离子反应方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,调pH的范围是3.2~3.9.
(3)步骤③加入ZnO调pH的原理是(用离子方程式表示)Cr3++3H2O?Cr(OH)3+3H+、ZnO+2H+=Zn2++H2O;铬泥的主要成分是Cr(OH)3.
(4)步骤④的操作方法是蒸发浓缩、冷却结晶、洗涤、干燥.
(5)由图可以看出在硫酸浸出Ca2+、Cr3+离子的过程中,Ca2+离子浸出率随温度的升高而减小,其原因是硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低,Cr3+离子浸出率受温度影响较小,可在常温下浸出,但在实验过程中为了降低溶液的黏度,改善浸出液的过滤性能,浸出液的温度维持在40-50℃,浸出流程中虽然没有加热设备,但仍能使浸出液保持在40-50℃的原因是浓硫酸稀释过程中会放出大量的热,浸出渣的主要成分是硫酸铅、硫酸钙.

已知:
①各离子开始沉淀和完全沉淀的pH值如下表:
| 离子 | Fe2+ | Fe3+ | Cr3+ | Zn2+ |
| 开始沉淀的pH值 | 5.9 | 2.3 | 3.9 | 5.7 |
| 完全沉淀的pH值 | 8.3 | 3.2 | 5.6 | 8.3 |

(1)请写出步骤①除铅的离子方程式:Pb2++SO42-=PbSO4↓.
(2)步骤②加入双氧水的离子反应方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,调pH的范围是3.2~3.9.
(3)步骤③加入ZnO调pH的原理是(用离子方程式表示)Cr3++3H2O?Cr(OH)3+3H+、ZnO+2H+=Zn2++H2O;铬泥的主要成分是Cr(OH)3.
(4)步骤④的操作方法是蒸发浓缩、冷却结晶、洗涤、干燥.
(5)由图可以看出在硫酸浸出Ca2+、Cr3+离子的过程中,Ca2+离子浸出率随温度的升高而减小,其原因是硫酸钙是微溶物且溶解度超过30℃以后,温度越高,溶解度越低,Cr3+离子浸出率受温度影响较小,可在常温下浸出,但在实验过程中为了降低溶液的黏度,改善浸出液的过滤性能,浸出液的温度维持在40-50℃,浸出流程中虽然没有加热设备,但仍能使浸出液保持在40-50℃的原因是浓硫酸稀释过程中会放出大量的热,浸出渣的主要成分是硫酸铅、硫酸钙.
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是cd(多选扣分).
a.容器中压强不变
b.c(CO2)=c(CO)
c.υ正(H2)=υ逆(H2O)
d.混合气体中c(CO)不变
(4)830K时,各物质浓度符合下式:c(CO2)•c(H2)=2c(CO)•c(H2O),此时该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”).
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(选填“吸热”、“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是cd(多选扣分).
a.容器中压强不变
b.c(CO2)=c(CO)
c.υ正(H2)=υ逆(H2O)
d.混合气体中c(CO)不变
(4)830K时,各物质浓度符合下式:c(CO2)•c(H2)=2c(CO)•c(H2O),此时该反应正反应方向进行(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”).
19.下列物质中,既有离子键,又含有共价键的物质是( )
| A. | H2SO4 | B. | CO2 | C. | NaOH | D. | HNO3 |
6.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的物质是( )
①NaHCO3②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3 ⑥Na[Al(OH)4].
①NaHCO3②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3 ⑥Na[Al(OH)4].
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | 全部 |
3.下列关于平衡体系的各说法中不正确的是( )
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 在H2S?H++HS-的平衡体系升温到100℃时,溶液中的c(H+)一定增大 | |
| D. | 在盐酸中加入KCl晶体,溶液pH不变 |
4.实验室里有4个药品橱,已经存放以下列试剂:
实验室新购进一些碘化钾,应该将这些碘化钾放在( )
| 药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
| 药品 | 醋酸,乙醇 | CuSO4•5H2O,MgCl2 | 白磷,硫黄 | 镁条,锌粒 |
| A. | 甲橱 | B. | 乙橱 | C. | 丙橱 | D. | 丁橱 |
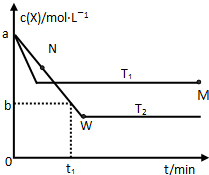 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.