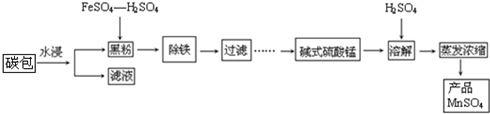
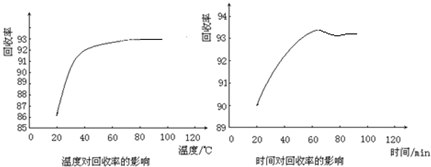
题目内容
2.下列各组中的物质反应时,反应条件或反应物的浓度改变时,不会引起产物改变的是( )| A. | Cu与硝酸 | B. | 澄清的石灰水与CO2 | ||
| C. | Na与O2 | D. | AlCl3与氨水 |
分析 A.铜和浓硝酸、稀硝酸反应生成的气体不同;
B.氢氧化钙和少量或过量二氧化碳反应时其产物不同;
C.钠和氧气反应在加热和不加热时,其产物不同;
D.氯化铝与氨水反应生成氢氧化铝.
解答 解:A.铜和浓硝酸反应生成二氧化氮,和稀硝酸反应生成一氧化氮,故A不选;
B.氢氧化钙和少量二氧化碳反应生成碳酸钙,和过量二氧化碳反应生成碳酸氢钙,故B不选;
C.钠和氧气在没有加热的条件下反应生成氧化钠,钠在空气中燃烧生成过氧化钠,故C不选;
D.氯化铝与氨水反应生成氢氧化铝,氢氧化铝不溶于弱碱氨水,则氯化铝与氨水反应产物只有一种,故D可选;
故选D.
点评 本题考查了物质间的反应,物质的浓度、反应条件、物质量的多少都可能影响产物,学习时注意总结归纳.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A. | 从开始到平衡A的平均反应速率为0.3mol/(Ls) | |
| B. | 从开始到平衡B的转化率为60% | |
| C. | 此反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$ | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
10.下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
(1)表中元素,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是H2SO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HCl.
(4)A和D组成化合物的电子式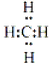 .
.
(5)用电子式表示B和H组成化合物的形成过程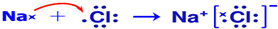
(6)B的最高价氧化物的水化物和C的最高价氧化物的水化物相互反应的离子方程式OH-+Al(OH)3═AlO2-+2H2O.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是H2SO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HCl.
(4)A和D组成化合物的电子式
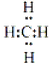 .
.(5)用电子式表示B和H组成化合物的形成过程
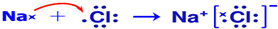
(6)B的最高价氧化物的水化物和C的最高价氧化物的水化物相互反应的离子方程式OH-+Al(OH)3═AlO2-+2H2O.
17.已知二甲苯的同分异构体有三种,从而可推知四氯苯的同分异构体数目是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
7.在一个5L的容器里,盛有8.0mol某气态反应物,5min后,测得这种气态反应物还剩余3.0mol,则这种反应物在此时间内的化学反应速率为( )
| A. | 0.1mol/(L•min) | B. | 0.2mol/(L•min) | C. | 0.3mol/(L•min) | D. | 0.4mol/(L•min) |
12.配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏大的是( )
| A. | 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时观察液面俯视 | |
| D. | 胶头滴管加水定容时,有少量水滴到容量瓶外 |
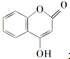 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: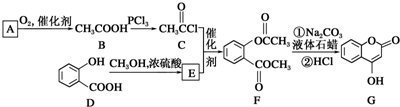
 .
. .
.