题目内容
8.1.5mol CO2中含1.5 mol碳原子,3NA个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为33.6L.分析 每个CO2分子含有1个C原子、2个O原子,则碳原子物质的量与CO2分子物质的量相等,氧原子物质的量为CO2分子的2倍,根据N=nNA计算氧原子数目,根据V=nVm计算二氧化碳的体积.
解答 解:每个CO2分子含有1个C原子、2个O原子,则n(C)=n(CO2)=1.5mol,n(O)=2n(CO2)=3mol,故氧原子数目为3mol×NAmol-1=3NA,标况下,二氧化碳的体积为1.5mol×22.4L/mol=33.6L,
故答案为:1.5;3NA;33.6.
点评 本题考查物质的量的有关计算,比较基础,注意理解掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
18.常温下,取浓度相等的NaOH和HCl溶液,以3:1体积比相混和,所得溶液的pH等于l2,则原溶液的浓度为( )
| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
19.下列叙述正确的是( )
| A. | 每个能级最多可容纳的电子数是2n2 | |
| B. | 在同一原子中没有运动状态完全相同的电子 | |
| C. | 同一能层中的不同能级的能量高低相同 | |
| D. | 不同能层中的s能级的能量高低相同 |
16.根据电子排布的特点,Co(钴)在周期表属于( )
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |
3.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| B. | 氯化钡溶液中滴加硫酸钠:Ba2++SO42-=BaSO4↓ | |
| C. | 稀盐酸滴在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| D. | 锌片投入硫酸铜溶液:Zn+CuSO4=ZnSO4+Cu |
1.根据元素性质递变规律,下列判断不正确的是( )
| A. | 酸性:H2SiO3<H3PO4<H2SO4 | B. | 电负性:I>Cl>Br>F | ||
| C. | 第一电离能:N>O>C | D. | 沸点:H2O>H2Te>H2Se>H2S |
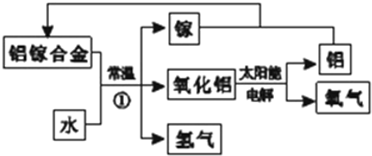 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.