题目内容
9.用所学知识回答问题:(1)浓硝酸久置常会显黄色,是因为4HNO3(浓)=2H2O+4NO2↑+O2↑(用化学反应方程式表示),可采用通入空气的方法消除黄色.
(2)酸性高锰酸钾溶液的氧化性比普通高锰酸钾的氧化性强,酸化时所用的酸为硫酸,向酸性KMnO4溶液中加入KI溶液,溶液紫红色褪去(所得溶液可使淀粉溶液变蓝),请写出KMnO4溶液褪色的离子方程式2MnO4-+10I-+16H+=2Mn2++5I2+8H2O
(3)硫化氢的水溶液久置于空气中会变浑浊,请写出相关的化学反应方程式2H2S+O2=2S↓+2H2O
(4)配平下面的化学方程式:3Cu2O+14 HNO3→6Cu(NO3)2+2NO↑+7H2O.
分析 (1)浓硝酸见光易分解,以此来解答;
(2)根据酸性高锰酸钾溶液的氧化性比氯气氧化性强,所以不能用盐酸来酸化;KMnO4溶液氧化KI溶液生成二价锰离子和碘单质,根据得失电子守恒书写;
(3)硫化氢的水溶液久置于空气中会变氧气氧化生成硫单质;
(4)Cu2O→2Cu2+,铜元素由+1价→+2价,化合价升高2价;HNO3→NO,氮元素由+5价→+2价,化合价降低3价,所以其最小公倍数为6,故Cu2O的系数为3,硝酸除表现氧化性之外还生成硝酸铜,表现酸性,据Cu原子守恒,硝酸铜前的化学计量数为6,据氮原子守恒和电子守恒,硝酸的化学计量数为14,然后利用质量守恒定律配平.
解答 解:(1)浓硝酸见光易分解,硝酸分解产生的NO2溶解于硝酸时其为黄色,方程式为:4HNO3(浓)=2H2O+4NO2↑+O2↑,可采用通入空气的方法与二氧化氮和水反应再生成硝酸,从而消除黄色,故答案为:4HNO3(浓)=2H2O+4NO2↑+O2↑;通入空气;
(2)因为酸性高锰酸钾溶液的氧化性比氯气氧化性强,所以酸性高锰酸钾溶液能氧化盐酸生成氯气,则不能用盐酸来酸化,应用硫酸酸化;KMnO4溶液氧化KI溶液生成二价锰离子和碘单质,离子方程式为2MnO4-+10I-+16H+=2Mn2++5I2+8H2O,故答案为:硫酸,2MnO4-+10I-+16H+=2Mn2++5I2+8H2O;
(3)硫化氢的水溶液久置于空气中会变氧气氧化生成硫单质,反应方程式为:2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O;
(4)Cu2O→2Cu2+,铜元素由+1价→+2价,化合价升高2价;HNO3→NO,氮元素由+5价→+2价,化合价降低3价,所以其最小公倍数为6,故Cu2O的系数为3,硝酸除表现氧化性之外还生成硝酸铜,表现酸性,据Cu原子守恒,硝酸铜前的化学计量数为6,据氮原子守恒和电子守恒,硝酸的化学计量数为14,然后利用质量守恒定律配平,方程式为3Cu2O+14HNO3→6Cu(NO3)2+2NO↑+7H2O,故答案为:3;14;6;2;7.
点评 本题考查氧化还原反应,根据元素化合价变化来分析解答即可,明确元素化合价的解本题的关键,难度不大,注重基础知识的考查.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中:2c(Ca2+)=c(NO3-) | |
| B. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子): c(Na+)>c(A-)>c(C1-)>c(OH-) | |
| C. | 0.1 mol/LNaAlO2溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH、CH3COONa的混合溶液中:2c(OH-)=2c(H+)+c(CH3COOH) |
| A. | 已烯、苯、四氯化碳 | B. | 已炔、己烯、四氯化碳 | ||
| C. | 已烷、苯、乙醇 | D. | 甲苯、苯、已烯 |
| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 非极性共价键只能存在于非金属单质中,不可能存在于化合物中 | |
| C. | 含有离子键的化合物一定是离子化合物,在离子化合物中可以含有非极性共价键 | |
| D. | 凡是能电离出离子的化合物都是离子化合物 |
| A. | 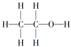 | B. | 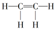 | C. |  | D. | 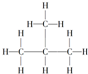 |
①H-C≡N ②H2O ③N2 ④H2O2⑤C2H4 ⑥C2H2.
| A. | ①③⑥ | B. | ③④⑤⑥ | C. | ①②③⑥ | D. | ③⑤⑥ |
| A. | 用碘水可以鉴别葡萄糖溶液和淀粉溶液 | |
| B. | 淀粉、油脂和蛋白质在一定条件下都能发生水解反应 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |