题目内容
把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:
(1)合金中镁、铝各物质的物质的量分别是多少?
(2)合金中镁、铝各物质的质量分别是多少?
(1)合金中镁、铝各物质的物质的量分别是多少?
(2)合金中镁、铝各物质的质量分别是多少?
考点:有关混合物反应的计算,镁的化学性质,铝的化学性质
专题:几种重要的金属及其化合物
分析:(1)涉及的反应方程式为:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,根据总质量、生成氢气的体积列式计算出合金中镁、铝各物质的物质的量;
(2)根据m=nM计算出合金中镁、铝的质量.
(2)根据m=nM计算出合金中镁、铝的质量.
解答:
解:(1)设镁、铝的物质的量分别为x和y,根据题意知标准状况下的氢气的物质的量为:n(H2)=
=0.25mol,
因盐酸足量,金属完全反应,根据反应方程式Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑可知,
则有如下关系:
,
解得:x=0.1mol,y=0.1mol,
答:合金中镁、铝各物质的物质的量都是0.1mol;
(2)该合金中镁和铝的质量分别为:m(Mg)=24g/mol×0.1mol=2.4g,m(Al)=27g/mol×0.1mol=2.7g,
答:该合金中镁和铝的质量分别为:2.4g、2.7g.
| 5.6L |
| 22.4L/mol |
因盐酸足量,金属完全反应,根据反应方程式Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑可知,
则有如下关系:
|
解得:x=0.1mol,y=0.1mol,
答:合金中镁、铝各物质的物质的量都是0.1mol;
(2)该合金中镁和铝的质量分别为:m(Mg)=24g/mol×0.1mol=2.4g,m(Al)=27g/mol×0.1mol=2.7g,
答:该合金中镁和铝的质量分别为:2.4g、2.7g.
点评:本题以镁铝合金为载体考查了根据方程式进行计算,题目难度中等,根据各物质之间的关系式结合守恒思想分析解答,试题培养了学生的分析、理解能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
可以用来鉴别Cl-、Br-、I-离子的是( )
| A、AgNO3溶液和稀硝酸 |
| B、观察它们的颜色 |
| C、用焰色反应进行实验 |
| D、分别向里滴加氯水 |
食盐、食醋、纯碱均为家庭厨房中常用的物质.利用这些物质不能完成的实验是( )
| A、鉴别食盐和纯碱 |
| B、验证蛋壳的主要成分为CaCO3 |
| C、除去热水瓶内壁上的水垢 |
| D、检验自来水中是否含有Cl- |
有两种金属组成的混合物粉末32g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是( )
①Fe、Zn ②Al、Cu ③Ag、Mg ④Al、Fe.
①Fe、Zn ②Al、Cu ③Ag、Mg ④Al、Fe.
| A、①②③④ | B、①②③ |
| C、①③ | D、②③④ |
下列检验某未知溶液中是否含有SO42-的操作中,最合理的是( )
| A、先加HCl酸化,再加BaCl2溶液 |
| B、加入HCl酸化了的BaCl2溶液 |
| C、先加HNO3酸化,再加Ba(NO3)2溶液 |
| D、加入HNO3酸化了的Ba(NO3)2溶液 |
“厨房化学”是指利用家庭生活用品来进行化学实验,从而对化学进行学习和探究的活动.下列实验在厨房中不能完成的是( )
| A、检验鸡蛋壳中含有碳酸盐 |
| B、检验蛋白质在加热条件下能发生变性 |
| C、检验加碘食盐中不含碘单质 |
| D、检验自来水中含有Cl-离子 |
下列有关实验原理、装置、操作或结论的描述中,正确的是( )
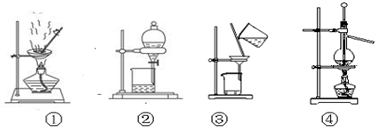

| A、用图①装置蒸发稀盐酸制浓盐酸 |
| B、用图②装置分液时,下层液体从分液漏斗下口放出,关闭活塞再将上层液体从上口倒出 |
| C、用图③洗涤沉淀时,漏斗中加入适量蒸馏水,搅拌并滤干 |
| D、用图④装置,分离四氯化碳与苯的混合溶液 |