题目内容
已知常温下Mg(OH)2的Ksp=1.8 。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
| A.0.18mol/L | B.1.8 mol/L mol/L | C.1.8 mol/L mol/L | D.2.0 |
A
解析试题分析:氢氧化镁溶液的PH=9,即溶液中c(OH-)=10-5mol/L,根据 Ksp=c(Mg2+)c(OH-)2=1.8×10-11,可求得c(Mg2+)= 0.18mol/L
考点:考查有关溶度积常数的计算

练习册系列答案
相关题目
将等物质的量浓度、等体积的硫酸与烧碱溶液混合后,滴入紫色石蕊试液,溶液呈( )
| A.紫色 | B.红色 | C.蓝色 | D.无色 |
分别在pH=2的酸和pH=12的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
| A.①② | B.② | C.②③ | D.④ |
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH CH3COO- +H+下列说法正确的是( )
CH3COO- +H+下列说法正确的是( )
| A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大 |
| B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小 |
| C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小 |
| D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大 |
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是
| A.此时水的离子积Kw=1×10-12 | B.水电离出的c(H+)=1×10-12 mol/L |
| C.水的电离程度随温度升高而增大 | D.c(Na+)=c(SO42-) |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )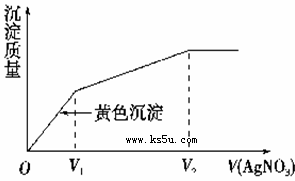
| A.(V2-V1)/V1 | B.V1/V2 |
| C.V1/(V2-V1) | D.V2/V1 |
汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3 H++HCO3-……① HCO3-
H++HCO3-……① HCO3- H++CO32-……②
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
| A.加热、平衡①、②可能都向左移动 |
| B.加入澄清石灰水,平衡①、②均向右移动 |
| C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动 |
| D.通入过量CO2或滴加氯水,溶液pH均减小 |
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO— + H3O+ HCOO— + H3O+ | B.CO2+H2O HCO3— + H+ HCO3— + H+ |
C.CO32— + H2O HCO3— + OH— HCO3— + OH— | D.HS— + H2O S2— + H3O+ S2— + H3O+ |
下列有关实验的原理、方法和结论都正确的是
| A.将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大 |
| B.用CH3COOH溶液作导电性实验,灯光较暗,说明CH3COOH是弱电解质 |
| C.向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |