题目内容
5.五种短周期元素的某些性质如下所示,有关说法不正确的是( )| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| N | 原子的M电子层上有3个电子 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
| Y | 元素最高价正价与最低负价的代数和为6 |
| A. | M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 由N和Y所形成的化合物中存在离子键,属于离子化合物 | |
| D. | N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应 |
分析 短周期元素中,M元素的最高价氧化物对应的水化物能与其气态氢化物生成盐,则M为N元素;N元素原子的M电子层上有3个电子,则M为Al;在短周期元素中,W元素原子半径最大,则W为Na;X元素原子最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O,则X为S元素;Y元素最高价正价与最低负价的代数和为6,则Y为Cl,据此分析.
解答 解:短周期元素中,M元素的最高价氧化物对应的水化物能与其气态氢化物生成盐,则M为N元素;N元素原子的M电子层上有3个电子,则M为Al;在短周期元素中,W元素原子半径最大,则W为Na;X元素原子最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O,则X为S元素;Y元素最高价正价与最低负价的代数和为6,则Y为Cl,
A.氨气分子中N元素处于最低价,具有还原性,其水溶液为碱性,故A正确;
B.钠在氧气中燃烧后的产物为过氧化钠,阴阳离子个数之比为1:2,故B正确;
C.N和Y所形成的化合物为AlCl3,只含有共价键,属于共价化合物,故C错误;
D.N、W、X的最高价氧化物对应的水化物,分别为氢氧化铝、氢氧化钠、硫酸,三种物质两两之间能相互发生反应,故D正确,
故选:C.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握,明确元素原子的电子排布以及元素化合物的性质是解题的关键,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
18.一种碳纳米管新型二次电池的装置如图所示,下列说法中正确的是( )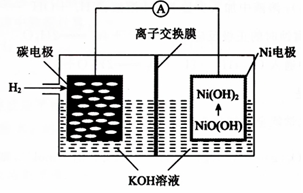

| A. | 离子交换膜选用阳离子交换膜(只允许阳离子通过) | |
| B. | 正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| C. | 导线中通过1mol电子时,理论上负极区溶液质量增加1g | |
| D. | 充电时,碳电极与电源的正极相连 |
16.下列物质属于氧化物的是( )
| A. | Cl2O | B. | H2SO4 | C. | C2H5OH | D. | KNO3 |
13.下列说法中,不正确的是( )
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
20.实验室制备一硝基甲苯(主要含邻硝基甲苯和对硝基甲苯)的反应原理、实验装置如图:
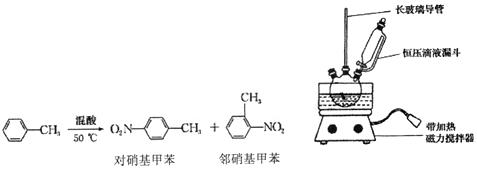
实验步骤:
①配制混酸,组装如图反应装置.取100mL 烧杯,用10mL 浓硫酸与30mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15mL 甲苯(折合质量13.0g)加入三颈烧瓶中.
②向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀.
③在50一60℃下发生反应,直至反应结束.
④除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
请回答下列问题:
(l)配制40mL 混酸的操作是分别取30mL浓硝酸和10mL浓硫酸,将30mL浓硝酸倒入烧杯中,再慢慢沿烧杯内壁注入10mL浓硫酸,边加边搅拌.
(2)装置中还缺少温度计 (填仪器名称).如果温度超过60℃,将会有二硝基甲苯或三硝基甲苯(填物质名称)生成.
(3)分离粗产品和水的操作方法是分液.
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是取最后一次洗涤液少许于试管中,滴加氯化钙溶液,无沉淀生成,则说明已洗净.
(5)为了得到更纯净的硝基苯,还须先向液体中加入CaO 除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是70.8%.

| 密度/(g•cm-3) | 沸点/℃ | 式量 | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
①配制混酸,组装如图反应装置.取100mL 烧杯,用10mL 浓硫酸与30mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15mL 甲苯(折合质量13.0g)加入三颈烧瓶中.
②向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀.
③在50一60℃下发生反应,直至反应结束.
④除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
请回答下列问题:
(l)配制40mL 混酸的操作是分别取30mL浓硝酸和10mL浓硫酸,将30mL浓硝酸倒入烧杯中,再慢慢沿烧杯内壁注入10mL浓硫酸,边加边搅拌.
(2)装置中还缺少温度计 (填仪器名称).如果温度超过60℃,将会有二硝基甲苯或三硝基甲苯(填物质名称)生成.
(3)分离粗产品和水的操作方法是分液.
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是取最后一次洗涤液少许于试管中,滴加氯化钙溶液,无沉淀生成,则说明已洗净.
(5)为了得到更纯净的硝基苯,还须先向液体中加入CaO 除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是70.8%.
10.据报道:研究人员破解了北京及华北地区雾霾主要成分硫酸盐的形成之谜,发现在大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径.某实验小组对NO2和SO2的反应进行探究.
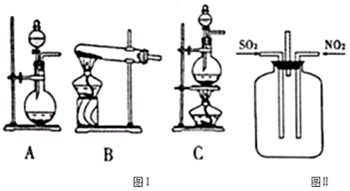
(1)SO2的发生装置可以选择图Ⅰ中的A(或C )(填字母),反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O[或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O].
(2)按图Ⅱ所示进行实验.
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为SO2+NO2=SO3+NO.如果集气瓶中有少量水,则可能观察不到白烟,其原因是生成的SO3与水反应生成硫酸.
②请指出图Ⅱ装置设计的不合理之处没有进行尾气处理,会导致环境污染.
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:

(1)SO2的发生装置可以选择图Ⅰ中的A(或C )(填字母),反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O[或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O].
(2)按图Ⅱ所示进行实验.
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为SO2+NO2=SO3+NO.如果集气瓶中有少量水,则可能观察不到白烟,其原因是生成的SO3与水反应生成硫酸.
②请指出图Ⅱ装置设计的不合理之处没有进行尾气处理,会导致环境污染.
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:
| 操作步骤 | 实验现象 | 结论 |
| 取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份. | ||
| 一份加入足量稀盐酸后,再加入BaCl2溶液. | 有白色沉淀生成. | 证明雾霾固体中含有SO42- |
| 另一份加入适量的NaOH浓溶液并加热. | 产生使湿润的红色石蕊试纸变蓝色的气体. | 证明雾霾固体中含有NH4+.综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4. |
14.硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应.某同学欲利用氯气和单质硼反应制备三氯化硼.已知BC13的沸点为12.5℃,熔点为-107.3℃,遇水剧烈反应,生成硼酸和盐酸.
(1)该同学选用如图所示的部分装置(可以重复选用)进行实验,装置依次连接的合理顺序为A、B、D、C、E、D、F.
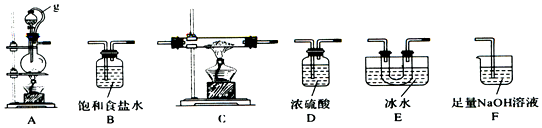
(2)A中反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E 的作用是冷凝并收集BC13.
(4)停止实验,正确的操作是先熄灭C处酒精灯,再拔F处导管,后熄灭A处酒精灯.
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4〕,则硼酸在水中的电离方程式是H3BO3+H2O═[B(OH)4]-+H+.
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LN a0H)滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案.
结论:NaClO使品红溶液褪色,溶液碱性越强褪色越慢.
(1)该同学选用如图所示的部分装置(可以重复选用)进行实验,装置依次连接的合理顺序为A、B、D、C、E、D、F.

(2)A中反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)图中g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,装置E 的作用是冷凝并收集BC13.
(4)停止实验,正确的操作是先熄灭C处酒精灯,再拔F处导管,后熄灭A处酒精灯.
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4〕,则硼酸在水中的电离方程式是H3BO3+H2O═[B(OH)4]-+H+.
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LN a0H)滴加品红溶液,发现溶液褪色.现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案.
| 实验序号 | 0.1mol/L NaClO溶液/mL | 0.1mol/L NaCl溶液/mL | 0.2mol/L NaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | 4.0 | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
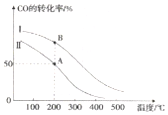 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下:
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.有关反应的热化学方程式如下: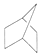 C.CH2=CH-CH=CH2 D.HOOCCH2CH2CH2Cl
C.CH2=CH-CH=CH2 D.HOOCCH2CH2CH2Cl
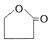 则E的结构简式NaOOCCH2CH2CH2OH,F生成五元环酯的化学方程式HOOCCH2CH2CH2OH$→_{△}^{浓硫酸}$
则E的结构简式NaOOCCH2CH2CH2OH,F生成五元环酯的化学方程式HOOCCH2CH2CH2OH$→_{△}^{浓硫酸}$