题目内容
15.KCl溶液中混有少量的CuSO4,若加入一种试剂能除去CuSO4.该试剂为( )| A. | Ba(OH)2 | B. | NaOH | C. | BaCl2 | D. | AgNO3 |
分析 CuSO4可与Ba(OH)2反应生成硫酸钡和氢氧化铜沉淀而除去,注意不能引入新杂质,以此解答该题.
解答 解:A.CuSO4能与Ba(OH)2反应生成硫酸钡沉淀和氢氧化铜沉淀,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确;
B.生成硫酸钠,引入新杂质,故B错误;
C.不能除去铜离子,故C错误;
D.生成AgCl沉淀,影响被提纯物质,故D错误.
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
6.下列说法中正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | 向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
3.根据题意回答问题:
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
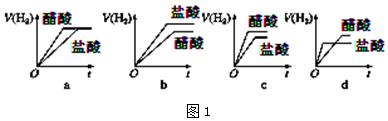
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).
(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.
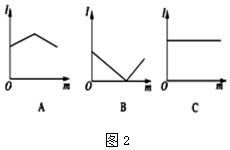
①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
①HSO3-的电离平衡常数表达式为:$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
①加水稀释10倍后,醋酸溶液中的c(H+)>盐酸溶液中的c(H+)(填“>”、“=”或“<”).
②加等浓度的NaOH溶液至恰好恰好中和,所需NaOH溶液的体积:醋酸>盐酸(填“>”、“=”或“<”).
③使温度都升高20℃,溶液中c(H+):醋酸>盐酸(填“>”、“=”或“<”).
④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图(图1)正确的是
c(填字母).

(2)图2是不的电解质溶液中加入新物质时溶液的导电性能发生变化性情况(电流强度(I)随新物质加入量(m)的变化曲线),将对应的图象字母填写在下列横线上.

①氢氧化钡溶液中滴入硫酸溶液至过量B.
②醋酸溶液中滴入氨水至过量A.
③澄清石灰水中通入CO2至过量B.
(3)已知表中的电离平衡常数,回答问题
| K1 | K2 | |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
②H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
10.硅酸铜钡是利用最新科学技术才合成的一种物质,然而科学家惊奇发现,我国秦朝兵马俑的一种颜料竟是硅酸铜钡.由以上事实推测关于硅酸铜钡的说法不正确的是( )
| A. | 难氧化 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 属于混合物 |
4.下列两种粒子的半径大小排列正确的是( )
| A. | Na>O | B. | Na+>O2- | C. | Mg>Na | D. | Mg2+>Na+ |
 某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题.
某学校设计了一节实验活动课,让学生从废旧干电池回收碳棒、锌皮、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题. 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.