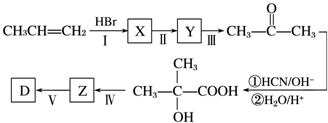
题目内容
5.下列说法正确的是( )| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 阴极发生还原反应,正极亦发生还原反应 | |
| C. | Cl2与碱溶液的反应,实质是HClO与OH-的反应 | |
| D. | 从氯水中分离出HClO,可加入CaCO3蒸馏 |
分析 A、根据离子中某元素的化合价来分析其氧化性或还原性;
B、电解池的阴极发生还原反应,原电池的正极发生还原反应;
C、Cl2与碱溶液的反应,实质是氯气与水反应生成有次氯酸和盐酸与碱反应;
D、碳酸钙可以和盐酸反应,但不会和次氯酸反应,对于反应Cl2+H2O?HCl+HClO,碳酸钙消耗了盐酸,促进反应向正方向移动,所以次氯酸会增加.
解答 解:A、最高价态的阳离子一般具有氧化性,如Fe3+;最低价的阴离子具有还原性,如I-;但Fe2+、SO32-都既有氧化性又有还原性,故A错误;
B、电解池的阴极发生还原反应,原电池的正极发生还原反应,故B正确;
C、Cl2与碱溶液的反应,实质是氯气与水反应生成有次氯酸和盐酸与碱反应,而不是单一的次氯酸与碱中和反应,故C错误;
D、碳酸钙可以和盐酸反应,但不会和次氯酸反应,对于反应Cl2+H2O?HCl+HClO,碳酸钙消耗了盐酸,促进反应向正方向移动,所以次氯酸会增加,故D正确;
故选BD.
点评 本题考查氧化还原反应中氧化性、还原性、氧化、还原反应,学生应学会利用化合价来分析问题,并能举出常见的例子来解答此类习题.

练习册系列答案
相关题目
16.将0.4mol/LNaHS溶液与0.2mol/LKOH溶液等体积混合,下列关系正确的是(已知HS-的水解程度大于电离程度)( )
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
20.已知反应:2A(g)?2B(g)+D(?);△H<0.在一定温度下,将1molA充入恒容密闭容器中充分反应达平衡,以下说法正确的是( )
| A. | 降低温度,当A质量不变时,说明该反应已达平衡 | |
| B. | 若D为气体,再加入1mol A,平衡正向移动,A的转化率增大 | |
| C. | 升高温度,正反应的平衡常数增大 | |
| D. | 若D为固体,再加入1mol A,平衡不移动,A在混合气体中的百分含量不变 |
17.下列醇中既能发生消去反应,又能被氧化为酮的是( )
① ②
② ③CH3OH④
③CH3OH④ ⑤
⑤ ⑥
⑥
①
 ②
② ③CH3OH④
③CH3OH④ ⑤
⑤ ⑥
⑥
| A. | ①④⑤ | B. | ④⑥ | C. | ②⑥ | D. | ①②⑥ |
14.在如图所示的微粒中,氧化性最强的是( )
| A. |  | B. |  | C. |  | D. |  |
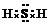 .
.
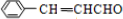 ;
; ;
;