题目内容
下列各表述与示意图一致的是( )


| A、图①表示N2O4(g)?2NO2(g)△H>0,N2O4转化率随温度、时间的变化 |
| B、图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化 |
| C、图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D、图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,使用和未使用催化剂时,反应过程中的能量变化 |
考点:化学平衡建立的过程
专题:图示题,化学平衡专题
分析:A、先拐先平,温度高T2>T1,反应是吸热反应,温度升高平衡正向进行;
B、反应是放热反应,升温平衡逆向进行;
C、n(Mn2+)开始为0,随反应的发生,增大,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,氧化还原反应结束后,其物质的量不再变化;
D、催化剂改变反应速率不改变化学平衡.
B、反应是放热反应,升温平衡逆向进行;
C、n(Mn2+)开始为0,随反应的发生,增大,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快,氧化还原反应结束后,其物质的量不再变化;
D、催化剂改变反应速率不改变化学平衡.
解答:
解:A.先拐先平,温度高T2>T1,反应是吸热反应,温度升高平衡正向进行,N2O4转化率增大,随温度、时间的变化图象不正确,故A错误;
B、反应2SO2(g)+O2(g)?2SO3(g)△H<0,升温平衡逆向进行,正反应平衡常数进行,逆反应平衡常数增大,故B正确;
C.n(Mn2+)开始为0,随反应的发生,增大,氧化还原反应结束后,其物质的量不再变化,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快
故,图象为 ,故C错误;
,故C错误;
D.催化剂降低反应所需的活化能,反应的始态、终态相同,曲线a为使用催化剂的情况,与图象一致,反应是放热反应,图象中反应物能量低于生成物为吸热反应不符合反应热量变化,故D错误;
故选B.
B、反应2SO2(g)+O2(g)?2SO3(g)△H<0,升温平衡逆向进行,正反应平衡常数进行,逆反应平衡常数增大,故B正确;
C.n(Mn2+)开始为0,随反应的发生,增大,氧化还原反应结束后,其物质的量不再变化,反应生成的Mn2+对该反应有催化作用,故反应速率越来越快
故,图象为
 ,故C错误;
,故C错误;D.催化剂降低反应所需的活化能,反应的始态、终态相同,曲线a为使用催化剂的情况,与图象一致,反应是放热反应,图象中反应物能量低于生成物为吸热反应不符合反应热量变化,故D错误;
故选B.
点评:本题考查了化学平衡图象分析判断,注意反应特征和平衡移动原理的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列有关同分异构体数目的叙述中,不正确的是( )
| A、1-氯-1-丙烯可以形成顺反异构 |
B、与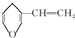 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
C、剧毒物质二恶英,其结构为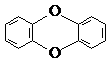 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种 ,已知它的二氯代物有10种同分异构体,则其六氯代物的同分异构体也有10种 |
| D、C11H16的苯的同系物中,经分析分子中除苯环外不含其他环状结构,还含有两个-CH3、两个-CH2-、一个-CH-,它的可能结构有4种 |
足量的镁粉与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不影响产生氢气的总质量,可以加入下列物质中的( )
| A、加入更稀的盐酸溶液 |
| B、NaOH |
| C、K2CO3 |
| D、CH3COONa |
制造水泥和玻璃都需用到的原料是( )
| A、粘土 | B、石英 | C、石灰石 | D、纯碱 |
相同温度下,1L pH均为4的盐酸、醋酸和氯化铵溶液中发生电离的水分子数分别为a、b、c,三者的大小顺序是( )
| A、a=b=c | B、a>b>c |
| C、c>a=b | D、无法确定 |
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图:MFe2Ox
MFe2Oy,则下列判断正确的是( )
| 常温下 |
| SO2 |
| A、MFe2Ox是氧化剂 |
| B、x<y |
| C、SO2是该反应的催化剂 |
| D、SO2发生氧化反应且氧化性:MFe2Oy>SO2 |
下列各项与反应热的大小无关的是( )
| A、反应物和生成物的状态 |
| B、反应物量的多少 |
| C、反应物的性质 |
| D、反应热的单位 |
下列电离方程式错误的是( )
| A、K2CO3═2K++CO32- |
| B、NaHSO4═H++SO42-+Na+ |
| C、KHCO3═K++H++CO32- |
| D、NH4Cl═NH4++Cl- |