题目内容
5.二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]•2H2O}制备流程如下: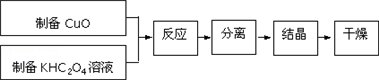
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①过滤所需的玻璃仪器有漏斗、烧杯、玻璃棒
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀,说明已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是ad
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为2KHC2O4+CuO$\frac{\underline{\;50℃\;}}{\;}$K2[Cu(C2O4)2]+H2O;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体.
(3)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到.从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗; b.降低硫酸铜的溶解度,有利于硫酸铜晶体析出.
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是回收乙醇.
分析 (1)①过滤一般在漏斗中进行,且用玻璃棒引流,用烧杯盛装滤液;
②CuO表面会附着硫酸根离子,用氯化钡溶液检验最后一次洗涤液中是否含有硫酸根离子判断是否洗涤干净;
(2)①提高氧化铜的利用率,可用氧化铜与KHC2O4溶液充分反应;
②CuO与KHC2O4溶液在50℃水浴加热条件下反应生成K2[Cu(C2O4)2]与H2O;
(3)从硫酸铜溶液中获得硫酸铜晶体时,为减少硫酸铜的溶解,可用加入少量乙醇,并用蒸馏的方法分离乙醇.
解答 解:(1)①过滤装置所需的玻璃仪器有漏斗、烧杯、玻璃棒,故答案为:漏斗、烧杯、玻璃棒;
②CuO表面会附着硫酸根离子,检验是否洗涤干净的具体方法是:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀,说明已洗涤干净,
故答案为:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀,说明已洗涤干净;
(2)①过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸或将滤纸灼烧成灰再将剩余的固体转入热的KHC2O4溶液,
故答案为:ad;
②根据题意可知,CuO与KHC2O4溶液在50℃水浴加热条件下反应生成K2[Cu(C2O4)2]与H2O,反应的方程式为:2KHC2O4+CuO$\frac{\underline{\;50℃\;}}{\;}$K2[Cu(C2O4)2]+H2O,
故答案为:2KHC2O4+CuO$\frac{\underline{\;50℃\;}}{\;}$K2[Cu(C2O4)2]+H2O;
(3)①从硫酸铜溶液中获得硫酸铜晶体时,为减少硫酸铜的溶解,降低硫酸铜的溶解度,有利于硫酸铜晶体析出,可用加入少量乙醇,
故答案为:降低硫酸铜的溶解度,有利于硫酸铜晶体析出;
②在蒸发浓缩的初始阶段还采用了蒸馏的方法,可起到回收乙醇的作用,故答案为:回收乙醇.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理和操作,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 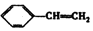 |
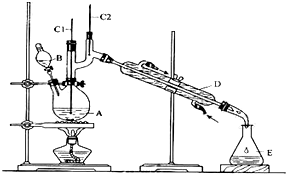
发生的反应如下:CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
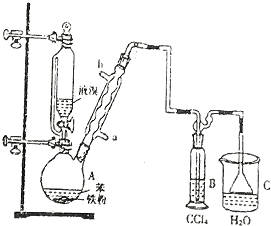
(1)将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.
(2)将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中并说明理由不能,因为浓硫酸的密度大,且溶于水放出大量的热,容易发生迸溅.
(2)若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(7)本实验中,正丁醛的产率为51%.
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: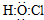 | |
| C. | 氮原子的结构示意图: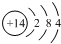 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
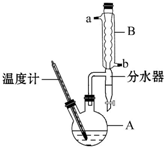 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:已知:Ⅰ.CH3CH2CH2OH+HBr$\stackrel{△}{→}$CH3CH2CH2Br+H2O
Ⅱ.2CH3CH2CH2OH$→_{140℃}^{浓硫酸}$(CH3CH2CH2)2O(正丙醚)+H2O
Ⅲ.可能用到的相关数据如下:
| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
①在A中加入50g正丙醇和一定量的浓硫酸、溴化钠一起加热(加入几粒沸石) ②保持69~72℃继续回流2小时 ③蒸馏,收集68~90℃馏出液
④用碳酸钠溶液洗至中性,分液 ⑤再蒸馏,收集68~76℃馏出液,得到纯净1-溴丙烷66g.
请回答:
(1)B装置名称是球形冷凝管,沸石的作用是防止液体暴沸.
(2)步骤①中浓硫酸、正丙醇和溴化钠的添加顺序为先加入正丙醇和溴化钠,再加入浓硫酸.
(3)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(4)为了防止副产物过多,本实验所用硫酸的浓度最好是c.
A.10% B.30% C.70% D.98.3%
(5)步骤④的目的主要是洗去硫酸,振摇后静置,粗产物应从分液漏斗的下(填“上”或“下”)口分离出.
(6)在粗产品蒸馏过程中,不可能用到的仪器有C、D(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶D.球形冷凝管 E.接收器
(7)本实验所得到的1-溴丙烷产率是C(填正确答案标号).
A.41% B.50% C.64% D.70%
| A. | 反应前后气体的压强之比为2:1 | |
| B. | 反应前后气体的密度之比为15:16 | |
| C. | 此时CO的转化率为50% | |
| D. | 如果反应继续向正向进行,气体的平均相对分子质量将减小 |
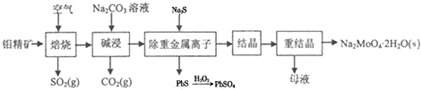
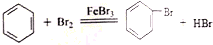 .
.