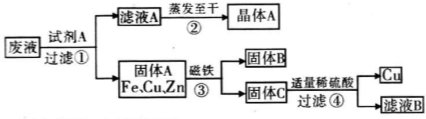
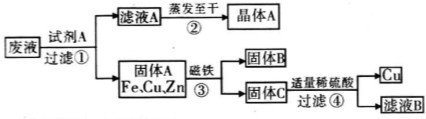
题目内容
| |||||||||||||||||||||||||||
解析:
(2) |
Zn+CuSO4 |
(3) |
使Zn完全溶解 |
(4) |
答案:0.64 mol 3.2n 提示:向废液中加入试剂A与CuSO4、ZnSO4、FeSO4反应后得到了固体Fe、Cu、Zn,而回收的物质中有ZnSO4,所以试剂A为过量的Zn,Zn与CuSO4、FeSO4发生置换反应:Zn+CuSO4 Mg(OH)2是一种难溶性碱,不能与CuSO4发生复分解反应得到Cu(OH)2.1000 g废液中含有CuSO4、ZnSO4、FeSO4的质量均为50 g,其中n(CuSO4)= |