题目内容
室温下,pH=13的NaOH溶液与pH=2的H2SO4溶液混合,所得混合溶液pH=11,则NaOH溶液与H2SO4溶液的体积比为( )
| A、11:1 | B、9:1 |
| C、1:11 | D、1:9 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:设出硫酸、氢氧化钠溶液的体积,pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=13的NaOH溶液中c(OH-)=10-1mol/L,两溶液混合pH=11,即c(OH-)=10-3mol/L,再结合n=cV表示出n(H+)、n(OH-),最后计算出二者体积之比.
解答:
解:设氢氧化钠溶液和硫酸溶液体积分别为V1和V2,则有混合后溶液中c(OH-)=10-3mol/L=
,V1:V2=1:9,
故选D.
| 10-1mol/LV1-10-2mol/LV2 |
| V1+V2 |
故选D.
点评:本题考查了混合溶液中pH的相关计算,注意酸和碱哪种物质过量的问题,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
下列说法正确的是( )
| A、强电解质溶液的导电性一定比弱电解质强 |
| B、医疗上血液的透析利用了胶体的性质,而用FeCl3紧急止血与胶体的性质无关 |
| C、氯水、氨水是混合物,盐酸是电解质,故盐酸是纯净物 |
| D、胶体与溶液的本质区别是分散质微粒的大小,可利用丁达尔现象区别溶液与胶体 |
对三种金属单质a、b、c进行下表所示实验(其他条件等同);
由上表实验结果分析可知,这三种金属的还原性由强到弱的顺序是( )
| 实验 金属 | a | b | c |
| 与冷水反应 | 不反应 | 缓慢反应 | 未实验 |
| 与2mol?1-1的HCl溶液反应 | 溶解并放出气体 | 未实验 | 不反应 |
| A、a>b>c |
| B、b>a>c |
| C、a>c>b |
| D、c>b>a |
下列的离子方程式正确的是( )
| A、用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ |
| B、Cu丝伸入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
| C、H2SO4溶液中滴入Ba(OH)2溶液:OH-+H+═H2O |
| D、氧化镁与盐酸混合:MgO+2H+=Mg2++H2O |





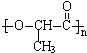 ,则形成该高聚物的单体结构简式为
,则形成该高聚物的单体结构简式为