题目内容
某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=
2×10-7mol/L
2×10-7mol/L
;若温度不变,滴入稀盐酸,使C(H+)=5×10-4mol/L,则溶液中C(OH-)=8×10-11mol/L
8×10-11mol/L
,此时溶液中由水电离产生的C(H+)=8×10-11mol/L
8×10-11mol/L
.分析:依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;依据离子积计算离子浓度;
解答:解:某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=2×10-7mol/L;若温度不变,滴入稀盐酸,使C(H+)=5×10-4mol/L,溶液中则溶液中C(H+)C(OH-)=10-14;
C(OH-)=8×10-11mol/L,此时溶液中由水电离产生的C(H+)=8×10-11mol/L;
故答案为:2×10-7mol/L;8×10-11mol/L;8×10-11mol/L;
C(OH-)=8×10-11mol/L,此时溶液中由水电离产生的C(H+)=8×10-11mol/L;
故答案为:2×10-7mol/L;8×10-11mol/L;8×10-11mol/L;
点评:本题考查了水的离子积应用,溶液中离子积的计算判断,题目较简单.

练习册系列答案
相关题目
下列说法正确的是( )
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ?mol-1 | 348 | 610 | 413 | 436 |
| A、已知某温度下纯水中的c (H+)=2×10-7mol?L-1,据此无法求出水中的c (OH-) |
| B、已知MgCO3的Ksp=6.82×10-6,则在含有固体MgCO3的MgCl2和Na2CO3溶液中,都有c (Mg2+)=c (CO32-),且Ksp (MgCO3)都保持不变 |
C、已知上表数据可以计算出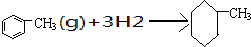 的焓变 的焓变 |
| D、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |