题目内容
下列说法正确的是( )
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ?mol-1 | 348 | 610 | 413 | 436 |
| A、已知某温度下纯水中的c (H+)=2×10-7mol?L-1,据此无法求出水中的c (OH-) |
| B、已知MgCO3的Ksp=6.82×10-6,则在含有固体MgCO3的MgCl2和Na2CO3溶液中,都有c (Mg2+)=c (CO32-),且Ksp (MgCO3)都保持不变 |
C、已知上表数据可以计算出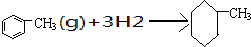 的焓变 的焓变 |
| D、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
分析:A.纯水中c (H+)=c (OH-);
B.MgCO3溶液中c (Mg2+)=c (CO32-);
C.苯中没有标准的单键和双键;
D.NH4+结合OH-使Mg(OH)2沉淀溶解平衡发生移动.
B.MgCO3溶液中c (Mg2+)=c (CO32-);
C.苯中没有标准的单键和双键;
D.NH4+结合OH-使Mg(OH)2沉淀溶解平衡发生移动.
解答:解:A.纯水中c (H+)=c (OH-)=2×10-7mol?L-1,故A错误;
B.因为两种溶液中c(CO32-)浓度不同,所以镁离子的浓度也是不同的,故B错误;
C.由于苯环中的化学键是一种介于碳碳单键和碳碳双键之间的一种独特的化学键,所以不能计算出该反应的反应热,故C错误;
D.NH4+结合OH-使Mg(OH)2沉淀溶解平衡向溶解方向移动,故D正确.
故选D.
B.因为两种溶液中c(CO32-)浓度不同,所以镁离子的浓度也是不同的,故B错误;
C.由于苯环中的化学键是一种介于碳碳单键和碳碳双键之间的一种独特的化学键,所以不能计算出该反应的反应热,故C错误;
D.NH4+结合OH-使Mg(OH)2沉淀溶解平衡向溶解方向移动,故D正确.
故选D.
点评:本题考查焓变和化学平衡等,注意理解影响化学平衡的因素.

练习册系列答案
相关题目