题目内容
【题目】请按要求回答下列问题。
(1)根据上图回答①②:
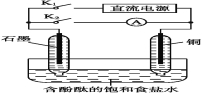
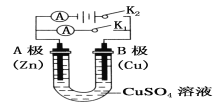
①打开K2,闭合K1。
A电极可观察到的现象是________________________________;
B极的电极反应式为___________________________________。
②打开K1,闭合K2。
A电极可观察到的现象是__________________________________;
B极的电极反应式为_____________________________________。
(2)根据下图回答③④:
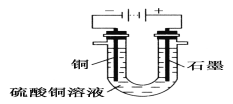
③将较纯净的CuSO4溶液放入上图所示的装置中进行电解,石墨电极上的电极反应式为___________________________________________________________,
电解反应的离子方程式为__________________________________________;
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
【答案】(1)①锌不断溶解 Cu2++2e-===Cu ②电极表面有红色固体附着 Cu-2e-===Cu2+
(2)③4OH--4e-===2H2O+O2↑2Cu2++2H2O![]() 2Cu+O2↑+4H+ ④
2Cu+O2↑+4H+ ④
【解析】
试题分析:(1)①若断开K2,闭合K1,形成原电池反应,Zn为负极,被氧化而锌不断溶解,Cu为正极,发生还原反应生成铜,电极方程式为Cu2++2e-═Cu;若断开K1,闭合K2,为电镀池,Cu为阳极,被氧化,发生Cu-2e-═Cu2+,Zn为阴极,发生还原反应,锌极镀上一层红色的铜。
(2)③电镀时,石墨为阳极,发生氧化反应,电极方程式为4OH--4e-═2H2O+O2↑,生成氧气,铜为阴极,总反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;④铜电极增重a g,n(Cu)=a/64mol,转移a/32mol电子,石墨电极反应4OH--4e-═2H2O+O2↑,生成n(O2)=a/4×32mol,则体积为(a/4×32)mol×22.4L/mol=L。
2Cu+O2↑+4H+;④铜电极增重a g,n(Cu)=a/64mol,转移a/32mol电子,石墨电极反应4OH--4e-═2H2O+O2↑,生成n(O2)=a/4×32mol,则体积为(a/4×32)mol×22.4L/mol=L。

 阅读快车系列答案
阅读快车系列答案