题目内容
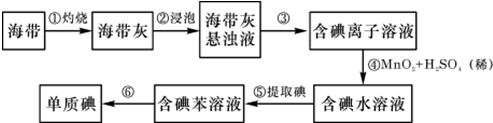
2.某同学依照如图所示流程提取海带中的碘元素.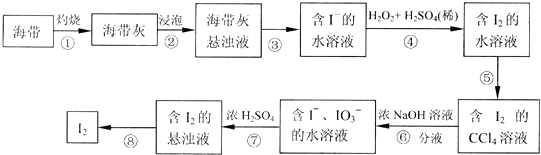
(1)步骤①中灼烧海带所用的仪器是b(填序号).
a.试管 b.坩埚 c.烧杯
(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是2I-+H2O2+2H+=I2+2H2O
(3)步骤⑤中采用的分离方法是萃取、分液.
(4)经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是从I2的CCl4溶液中分离出I2.
(5)步骤⑦的反应中,当1molIO3-发生反应时,转移电子的物质的量是5mol.
分析 海带灼烧加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质;
(1)灼烧固体需要使用仪器坩埚;
(2)酸性条件下的过氧化氢做氧化剂氧化碘离子为碘单质,本身被还原为水;
(3)从碘水中提取碘的方法为萃取分液;
(4)经步骤⑤得到含I2的CCl4溶液后,需要从I2的CCl4溶液中分离出I2;
(5)发生反应为:5I-+IO3-+6H+=3I2+3H2O,故由1molIO3-发生反应时,转移5mol电子.
解答 解:海带灼烧加入蒸馏水溶解过滤除去不溶性杂质,加入稀硫酸酸化加入过氧化氢氧化碘离子为碘单质,加入四氯化碳萃取分液得到碘单质的四氯化碳溶液,蒸馏得到碘单质;
(1)灼烧固体需要使用仪器坩埚,故答案为:b;
(2)酸性条件下的过氧化氢做氧化剂氧化碘离子为碘单质,本身被还原为水,反应为2I-+H2O2+2H+=I2+2H2O,故答案为:2I-+H2O2+2H+=I2+2H2O;
(3)从碘水中提取碘的方法为萃取分液,故答案为:萃取、分液;
(4)经步骤⑤得到含I2的CCl4溶液后,需要从I2的CCl4溶液中分离出I2,故答案为:从I2的CCl4溶液中分离出I2;
(5)发生反应为:5I-+IO3-+6H+=3I2+3H2O,故由1molIO3-发生反应时,转移5mol电子,故答案为:5.
点评 本题考查海带成分中碘的检验,注意掌握萃取和分液的使用条件,书写离子方程式的方法及相关计算,题目难度中等.

练习册系列答案
相关题目
4.下列有关电子云和原子轨道的说法正确的是( )
| A. | 原子核外的电子像云雾一样笼罩在原子核周围,故称电子云 | |
| B. | s轨道呈球形,处在该轨道上的电子只能在球壳内运动 | |
| C. | p轨道呈哑铃形,在空间有两个伸展方向 | |
| D. | 与s电子原子轨道相同,p电子原子轨道的平均半径随能层的增大而增大 |
5.下列化学用语使用正确的是( )
| A. | 葡萄糖、淀粉的最简式都是CH2O | B. | 醋酸钠的分子式:CH3COONa | ||
| C. | CH4的电子式是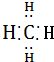 | D. | 丙烷分子的球棍模型是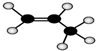 |
11.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
(1)化学反应速率本质上是由反应物本身的性质决定的,但外界条件也会影响反应速率的大小.本实验中实验2和实验3表明温度对反应速率有影响.
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2mol/L.
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(2)我们最好选取实验1、2和4(填3个实验序号)研究锌的形状对反应速率的影响.我们发现在其它条件相同时,反应物间的接触面积越大反应速率越快.
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快.原因是锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率.
(4)利用表中数据,可以求得:硫酸的物质的量浓度是2mol/L.
12.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物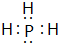 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物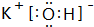 ;
;
(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号)
(3)按要求写出下列两种物质的电子式:⑥的氢化物
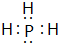 ; ⑨的最高价氧化物的对应的水化物
; ⑨的最高价氧化物的对应的水化物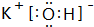 ;
;(4)由H和①形成的原子数之比为1:1的物质H2O2 (填化学式).
(5)利用⑧的单质制备漂白粉发生反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(6)⑤的最高价氧化物对应的水化物既能与③的最高价氧化物对应的水化物反应,也能与⑧的最高价氧化物对应的水化物反应.分别写出其反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O.
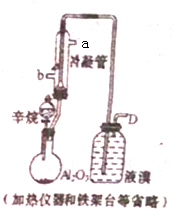 现以C8H18为原料经裂解制得乙烯,进而制得1,2.二溴乙烷,根据如图所示装置,结合有关知识回答问题:
现以C8H18为原料经裂解制得乙烯,进而制得1,2.二溴乙烷,根据如图所示装置,结合有关知识回答问题: