题目内容
15.以下我国古代的制作或技术涉及到化学反应的是( )| A.烧制陶罐 | B.雕刻石雕 | C. 水车灌溉 | D.预报地震 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.烧制陶罐生成硅酸盐;
B.雕刻石雕没有新物质生成;
C.水车灌溉没有新物质生成;
D.预报地震没有新物质生成.
解答 解:A.烧制陶罐生成硅酸盐,有新物质生成,属于化学变化,故A正确;
B.雕刻石雕没有新物质生成,属于物理变化,故B错误;
C.水车灌溉没有新物质生成,属于物理变化,故C错误;
D.预报地震没有新物质生成,属于物理变化,故D错误.
故选A.
点评 本题考查物理变化与化学变化的区别与联系,涉及化学反应与生活、生产的考查,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
11.下列反应中,属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Ca(ClO)2+2HCl═CaCl2+2HClO |
12.下列物质的焰色反应是紫色的是( )
| A. | 钾及其化合物 | B. | 铜及其化合物 | C. | 锂及其化合物 | D. | 钠及其化合物 |
3.描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp).
表1
表2
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是HCN(用化学式表示).下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是B(填序号).
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”或“碱性”),溶液中各离子浓度大小关系是c(NH4+)=c(CH3COO-)>c(OH-)=c(H+).
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中电荷守恒等式为c(Na+)+c(H+)=c(CN-)+c(OH-).
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2).具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3.现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L-1,则溶液中CO32-物质的量浓度应≥0.26mol•L-1.
表1
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
(1)表1所给的四种酸中,酸性最弱的是HCN(用化学式表示).下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是B(填序号).
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈中性(选填“酸性”、“中性”或“碱性”),溶液中各离子浓度大小关系是c(NH4+)=c(CH3COO-)>c(OH-)=c(H+).
(3)物质的量之比为1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中电荷守恒等式为c(Na+)+c(H+)=c(CN-)+c(OH-).
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2).具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3.现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01mol•L-1,则溶液中CO32-物质的量浓度应≥0.26mol•L-1.
20.在众多的新能源中,氢能将会成为21世纪最理想的能源.
Ⅰ.已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数
据如下:
(1)H2燃烧的热化学方程式是2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol.
(2)H2可以代替原煤和汽油作为新能源的依据是相同条件下,等质量的H2燃烧放出的热量大于原煤和汽油,产物无污染,可循环利用.
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
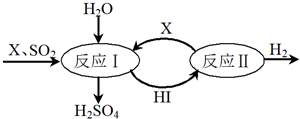
Ⅱ.如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2.
请回答:
(1)该过程可循环利用的物质是I2和HI(写化学式).
(2)该过程总反应的化学方程式是SO2+2H2O=H2SO4+H2.
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中
Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
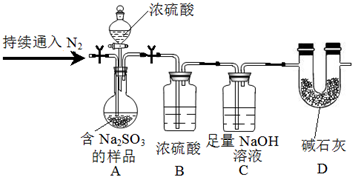
①装置B的作用是干燥SO2.
②测定样品中Na2SO3的质量分数所需的数据是含Na2SO3的样品质量、装置C通入SO2前后的质量.
Ⅰ.已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数
据如下:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(2)H2可以代替原煤和汽油作为新能源的依据是相同条件下,等质量的H2燃烧放出的热量大于原煤和汽油,产物无污染,可循环利用.
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
Ⅱ.如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2.

请回答:
(1)该过程可循环利用的物质是I2和HI(写化学式).
(2)该过程总反应的化学方程式是SO2+2H2O=H2SO4+H2.
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中
Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):

①装置B的作用是干燥SO2.
②测定样品中Na2SO3的质量分数所需的数据是含Na2SO3的样品质量、装置C通入SO2前后的质量.
7.已知甲醇的燃烧热数值为726.51kJ•mol-1.下列热化学方程式书写正确的是( )
| A. | CH4O+$\frac{3}{2}$O2═CO2+2H2O△H=-726.51 kJ•mol-1 | |
| B. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=+726.51 kJ•mol-1 | |
| C. | 2CH4O(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1453.12 kJ•mol-1 | |
| D. | CH4O(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-726.51 kJ•mol-1 |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.1 mol Cl2含有的氯原子数为0.1NA | |
| B. | 3.4 g NH3含有的分子数为0.2NA | |
| C. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| D. | 100 mL 0.1 mol/L的Na2SO4溶液中,Na+数为0.01 NA |
5.下列物质不属于强电解质的是( )
| A. | 硫酸 | B. | 醋酸 | C. | 氢氧化钡 | D. | 硫酸钡 |