题目内容
3.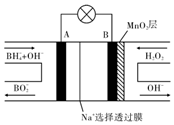 新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从B极区移向A极区 | |
| C. | 电池负极的电极反应为:BH4+8OH--8e一═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
分析 由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,再结合离子移动方向分析判断.
解答 解:A.电极B材料中包含MnO2层,二氧化锰能促进双氧水分解,所以MnO2可起催化作用,故A正确;
B.原电池工作时,阳离子向正极移动,则Na+从A极区移向B极区,故B错误;
C.负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子数为1mol/L×1L×2=2mol,故D正确.
故选B.
点评 本题考查了原电池原理,根据微粒中化合价变化确定正负极,再结合元素化合价变化、离子移动方向等知识点分析解答,难点是电极反应式书写,题目难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
13.在容积不变的密闭容器中进行反应X(g)+Y(g)?2Z(g)+W(s),己知反应中X、Y 的起始浓度分别为0.1mol•L-1、0.2mol•L-1,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是( )
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
11. “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
 “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )| A. | c极上发生的电极反应是:O2+4H++4e-═2H2O | |
| B. | 当有0.1mol电子转移时,b极产生1.12L 气体Y(标准状况下) | |
| C. | 装置I与装置II的电解质溶液中,氢离子运动方向相反 | |
| D. | RFC系统工作过程中只存在3种形式的能量转化 |
8.下列说法正确的是( )
| A. | CO2的电子式为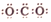 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
15.不需要通过氧化还原反应就能从海水中获得的物质是( )
| A. | 液溴 | B. | 精盐 | C. | 钠 | D. | 烧碱 |
2.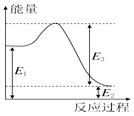 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)══2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)══CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)══CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1.
(2)若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ
B.E2=36kJ
C.E1-E2=36kJ
D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1=a kJ•mol-1(CO结构式为C≡O).又知某些化学键的键能数值如表:
则a=-116,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量为QkJ,
则Q<|a|(用>,<或=填空).
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:①2H2(g)+O2(g)══2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)══CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)══CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1.
(2)若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ
B.E2=36kJ
C.E1-E2=36kJ
D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1=a kJ•mol-1(CO结构式为C≡O).又知某些化学键的键能数值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
则Q<|a|(用>,<或=填空).
3.下列有关说法中正确的是( )
| A. | Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| B. | 在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变 | |
| C. | 已知Ksp(AgCl)>Ksp(AgI),则反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 | |
| D. | 在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
 钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:
钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示: