题目内容
【题目】铜及其合金是人类最早使用的金属材料。
(1)基态铜原子的外围电子排布式为_____________。
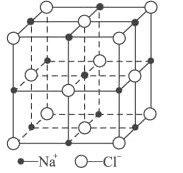
(2)图1是Cu2O的晶胞,Cu原子配位数为_____________。若Cu2O晶体密度为dgcm-3,晶胞参数为apm,则阿伏加德罗常数值NA=___________。

(3)科学家通过X 射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可表示如图2。
①SO42-中S原子的杂化类型为_______,SO42-的空间构型构型是___________;写出一个与SO42-互为等电子体的分子的化学式__________。
②胆矾的化学式用配合物的形式可表示为___________。1mol 胆矾所含σ键的数目为:_______(设阿伏加德罗常数值NA)
③已知胆矾晶体受热失水分三步。上图2中两个仅以配位键与铜离子结合的水分子最先失去,大致温度为102℃。两个与铜离子以配位键结合,并且与外部的一个水分子以氢键结合的水分子随温度升高而失去,大致温度为113 ℃。而失去最外层水分子所需温度大致为258℃,请分析原因_____________。
【答案】 3d104s1 2 288×1030/da3 sp3杂化 正四面体 CCl4 [Cu(H2O)4] SO4·H2O 18 NA 因为它的氢原子与周围的硫酸根离子中的氧原子之间形成氢键,它的氧原子又和与铜离子配位的水分子的氢原子之间形成氢键,总体上构成一种稳定的环状结构,破坏这个结构需要较高能量
【解析】试题分析:本题考查物质结构与性质,主要考查外围电子排布式的书写,晶胞的分析和计算,杂化方式和空间构型的判断,等电子原理,σ键的计算。
(1)Cu的原子序数为29,基态Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,基态Cu原子的外围电子排布式为3d104s1。
(2)用“均摊法”,白球有:8![]() +1=2个,黑球有:4个,晶体的化学式为Cu2O,黑球为Cu,白球为O,O的配位数为4,Cu的配位数为2。晶胞的体积为(apm)3=(a
+1=2个,黑球有:4个,晶体的化学式为Cu2O,黑球为Cu,白球为O,O的配位数为4,Cu的配位数为2。晶胞的体积为(apm)3=(a![]() 10-10cm)3,1mol晶体的质量为(a
10-10cm)3,1mol晶体的质量为(a![]() 10-10cm)3
10-10cm)3![]() 2
2![]() NA
NA![]() dg/cm3=144g,则阿伏加德罗常数值NA=
dg/cm3=144g,则阿伏加德罗常数值NA=![]() 。
。
(3)①SO42-中中心原子S上的孤电子对数为![]() (6+2-4
(6+2-4![]() 2)=0,成键电子对数为4,价层电子对数为0+4=4,S原子的杂化类型为sp3杂化。SO42-的VSEPR模型为正四面体型,由于S上没有孤电子对,SO42-的空间构型为正四面体型。用替代法,与SO42-互为等电子体的分子的化学式为SiF4、CCl4等。
2)=0,成键电子对数为4,价层电子对数为0+4=4,S原子的杂化类型为sp3杂化。SO42-的VSEPR模型为正四面体型,由于S上没有孤电子对,SO42-的空间构型为正四面体型。用替代法,与SO42-互为等电子体的分子的化学式为SiF4、CCl4等。
②根据图示胆矾晶体中Cu2+与4个H2O分子形成配位键,1个H2O分子在外部,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4·H2O。每个H2O分子中含2个σ键,SO42-中含4个σ键,1个Cu2+与4个H2O形成4个配位键,配位键也属于σ键,1mol胆矾中含有σ键的物质的量为(4+5![]() 2+4)mol=18mol,含σ键的数目为18NA。
2+4)mol=18mol,含σ键的数目为18NA。
③胆矾晶体受热失水分三步:首先两个仅以配位键与铜离子结合的水分子最先失去;接着两个与铜离子以配位键结合,并且与外部的一个水分子以氢键结合的水分子随温度升高而失去;最后失去最外层水分子,即最外层水分子最难失去,根据图示,这是因为最外层水分子的氢原子与周围的硫酸根离子中的氧原子之间形成氢键,它的氧原子又和与铜离子配位的水分子的氢原子之间形成氢键,总体上构成一种稳定的环状结构,破坏这个结构需要较高能量。

【题目】将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2ONaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为____mol。
(2)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | S |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为______________,产品2的化学式为______,1 L浓海水最多可得到产品2的质量为___g。
(3)电解熔融的氯化镁时发生反应的化学方程式为_____________;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式__________________。
【题目】活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)= mol·L-1·min-1;
(2)该反应的化学方程式是________________________________________;
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_____ 。
①v(NO)∶v(A)∶v(B)=2∶1∶1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O。

①a处通入的物质是____,电极反应式为:______;
②b处电极反应式为_________________________;
③电池工作时H+由 极移向 极(填正、负极)。