题目内容
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+===Cu+Cu2++H2O。
实验探究一 学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
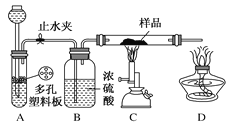
(1)仪器组装完成后,夹好止水夹,_________________,则说明装置A的气密性良好。
(2)从下列实验步骤中,选择正确的操作顺序:__________________(填序号)。
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹 ④点燃C处的酒精喷灯 ⑤收集氢气并验纯
实验探究二
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是________(填选项字母)。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体证明样品中一定含有________,写出产生上述气体的化学方程式:______________________。
实验探究三
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体3.2 g,测得滤液中Fe2+有1.0 mol,则样品中n(Cu2O)=___ mol。
【答案】(1)向装置A中的长颈漏斗内注入液体至形成一段液注,过一段时间若液柱高度保持不变(2分)
(2)①⑤④②③(2分) (3)C(2分) Cu2O (2分)
Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;(2分) (4)0.55 (2分)
【解析】
试题(1)仪器组装完成后,夹好止水夹,在长颈漏斗中加水形成一段水柱,且不发生变化证明气密性完好,向装置A中的长颈漏斗内注入液体至形成一段液注,过一段时间若液柱高度保持不变,则说明装置A的气密性良好。
(2)氢气混有空气加热发生爆炸,所以开始先通氢气,打开止水夹生成氢气,通过后续装置充满氢气,目的是排出装置中的空气,检验最后U型管出来的气体氢气纯度,气体纯净后再点燃C处的酒精喷灯,反应完成后先撤酒精灯,玻璃管冷却再停氢气,然后熄灭C处的酒精喷灯,待C处冷却至室温后,关闭止水夹,防止生成的铜被空气中氧气氧化,正确的存在顺序为:①⑤④②③;
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是________。
A.若固体全部溶解,说明样品中一定含有Fe2O3,由于铁离子能氧化金属铜,所以不一定不含有Cu2O,A错误;B.若固体部分溶解,说明样品中一定含有Cu2O,由于铁离子能氧化金属铜,所以不一定不含有Fe2O3,B错误;C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,即不存在亚铁离子,由于铁离子能氧化金属铜,所以说明样品一定含有Fe2O3和Cu2O,C正确;
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,这说明硝酸被还原,因此证明样品中一定含有Cu2O,产生上述气体的化学方程式为Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O。
(4)2Fe3++Cu=Cu2++2Fe2+,Cu2O+2H+═Cu+Cu2++H2O,固体为铜,铁离子全部反应生成亚铁离子,生成1.0molFe2+,消耗Cu 0.5mol,剩余Cu物质的量=3.2g÷64g/mol=0.05mol,原样品中Cu2O物质的量=0.05mol+0.5mol=0.55mol.。