题目内容
18.已知相同条件下,下列反应的焓变和乎衡常数分别表示为:①2H2O(g)=O2(g)+2H2(g)△H1 K1=x
②Cl2(g)+H2(g)=2HCl(g)△H2 K2=y
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3 K3=x
则下列关系正确的是( )
| A. | △H3=△H1+2△H2 x=xy2 | B. | H3=△H1+△H2 z=x+y | ||
| C. | H3=△H1+2△H2 x=x-y2 | D. | H3=△H1+△H2 z=$\frac{x}{y}$ |
分析 根据三个化学反应方程式可知,反应2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)可由另两个反应加和得到,则由盖斯定律可知,△H3应为另两个反应反应热的加和,以此计算平衡常数关系.
解答 解:①2H2O(g)=2H2(g)+O2(g)△H1;
②H2(g)+Cl2(g)=2HCl(g)△H2 ;
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3;
则反应③=①+2×②,
由盖斯定律可知,
△H3=△H1+2△H2,
且x=xy2,
故选A.
点评 本题考查学生利用盖斯定律来计算反应热的关系以及平衡常数的计算,为高频考点,明确化学反应的关系,在加和反应时等号同侧的相加,当乘以一个系数时反应热也要乘以这个系数来解答即可.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
9.亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量).
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 亚硫酸盐作为食品添加剂,作用是防腐保鲜 | |
| B. | 反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
6.以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图.

关于该过程的相关叙述正确的是( )

关于该过程的相关叙述正确的是( )
| A. | 反应④的反应类型是加聚 | B. | 物质A含有两种官能团 | ||
| C. | 物质B催化氧化后可以得到乙醛 | D. | 1mol物质D最多可以消耗2molNaOH |
3.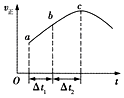 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
10.下列说法正确的是( )
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | 在“中和热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 |
3.如图1,科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环:
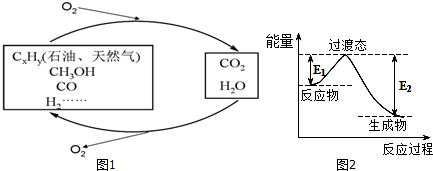
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.
已知破坏1mol不同共价键的能量(kJ)分别是:
已知E1=8.2kJ•mol-1,则E2=198.8kJ•mol-1.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的△H<0(填“<”或“>”).
②实验2条件下的平衡常数K=$\frac{1}{3}$.
③实验3中,若平衡时H2O的转化率为25%,则$\frac{a}{b}$=0.5.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正<V逆(填“<”或“>”或“=”).
(3)捕捉CO2可以利用Na2CO3溶液.先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理反应后的溶液存在HCO3-?CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”.

(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.
已知破坏1mol不同共价键的能量(kJ)分别是:
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
②实验2条件下的平衡常数K=$\frac{1}{3}$.
③实验3中,若平衡时H2O的转化率为25%,则$\frac{a}{b}$=0.5.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正<V逆(填“<”或“>”或“=”).
(3)捕捉CO2可以利用Na2CO3溶液.先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理反应后的溶液存在HCO3-?CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”.

 .
.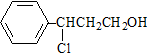 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.