题目内容
3.在氧化还原反应CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2中,每有1molCu生成,转移电子的物质的量为( )| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 3mol |
分析 CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2反应中Cu元素的化合价从+2价降低到0价,得到2个电子,据此分析.
解答 解:CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2反应中Cu元素的化合价从+2价降低到0价,得到2个电子,则每有1molCu生成,转移2mol电子;
故选C.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,注意被氧化的元素种类,知道硝酸的作用,题目难度不大.

练习册系列答案
相关题目
13.以酸性氢氧燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )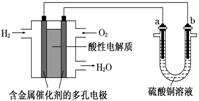

| A. | a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
14.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
11.化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒 | |
| B. | “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适 | |
| C. | 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 |
15.某溶液中存在大量的Cl-、SO42-、H+.该溶液中还可能大量存在的离子是( )
| A. | OH- | B. | Ba2+ | C. | Na+ | D. | Ag+ |
12.下列有关化学用语的表示正确的是( )
| A. | N2的电子式: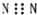 | |
| B. | 甲烷分子的比例模型是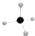 | |
| C. | 硝基和二氧化氮两种粒子所含电子数相等 | |
| D. | 中子数为10的氧原子:${\;}_{8}^{10}$O |
13.鉴别新制氯水和盐酸这两种溶液时,最合适的试剂是( )
| A. | AgN03溶液 | B. | 淀粉-KI溶液 | C. | Na2CO3溶液 | D. | 酚酞溶液 |

 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题: