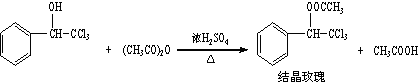
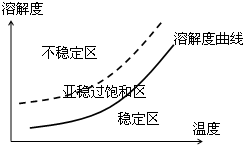
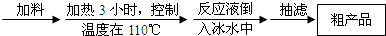题目内容
能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A、CO2溶于水形成碳酸,SiO2难溶于水 |
| B、CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C、高温下SiO2与碳酸盐反应生成CO2 |
| D、HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:据化学反应遵循强酸制弱酸的原则,比较碳酸比硅酸强的反应应在水溶液中进行.
解答:
解:A、氧化物的水溶性不能决定其水化物的酸性强弱,故A错误;
B、二氧化碳和水反应生成碳酸,碳酸和可溶性硅酸盐反应析出硅酸沉淀,说明碳酸能制取硅酸,所以能证明碳酸酸性强于硅酸酸性,故B正确;
C、特殊条件下,SiO2与碳酸盐反应生成CO2不能证明碳酸酸性强于硅酸酸性,是利用了物质的稳定性,故C错误;
D、氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀,根据强酸制弱酸,只能说明盐酸的酸性比碳酸强,又盐酸易挥发,可溶性硅酸盐溶液中生成沉淀,可能为盐酸与硅酸盐的反应,则无法确定碳酸与硅酸的酸性的强弱,故D错误;
故选B.
B、二氧化碳和水反应生成碳酸,碳酸和可溶性硅酸盐反应析出硅酸沉淀,说明碳酸能制取硅酸,所以能证明碳酸酸性强于硅酸酸性,故B正确;
C、特殊条件下,SiO2与碳酸盐反应生成CO2不能证明碳酸酸性强于硅酸酸性,是利用了物质的稳定性,故C错误;
D、氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀,根据强酸制弱酸,只能说明盐酸的酸性比碳酸强,又盐酸易挥发,可溶性硅酸盐溶液中生成沉淀,可能为盐酸与硅酸盐的反应,则无法确定碳酸与硅酸的酸性的强弱,故D错误;
故选B.
点评:根据强酸制弱酸原理,必须在溶液中发生的化学反应,因此C选项,不能得出硅酸的酸性比碳酸强.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、(CH3)2C═CHCH2CH3分子中的六个碳原子中至少有五个在同一个平面上 |
| B、液化石油气和天然气的主要成分都是甲烷 |
| C、乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
| D、间二溴苯仅有一种空间结构,这可以证明苯分子中不存在单双键交替的结构 |
下列物质的转变在给定条件下不能实现的是( )
A、N2
| |||||
B、Al2O3
| |||||
C、S
| |||||
D、SiO2
|
生活中处处有化学,下列表述不正确的是( )
| A、对不可回收的垃圾常用的处理方法有卫生填埋、堆肥和焚烧 |
| B、制造玻璃是复杂的物理变化,玻璃的组成不同,性能也不同 |
| C、血糖过低的患者可利用静脉注射葡萄糖溶液的方法迅速补充营养 |
| D、固体煤经处理变为气体燃料后,可以减少SO2和烟尘的污染,且燃烧效率高 |
两个容积相同的容器中,一个盛有CO 气体,另一个盛有N2气.在同温同压下,两容器内的气体一定具有相同的:①分子数 ②原子数 ③质量 ④质子数 ⑤电子数( )
| A、只有①② | B、只有①②③ |
| C、只有①②④ | D、全部 |
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA |
| C、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA |
| D、常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NA |
下列叙述中正确的是( )
| A、摩尔是物质的质量的单位 |
| B、碳的摩尔质量为12g |
| C、一个氧原子的质量为16g/mol |
| D、阿伏加德罗常数约为6.02×1023mol-1 |
下列各组元素中原子序数按由大到小顺序排列的是( )
| A、Be、C、B |
| B、Cl、O、Li |
| C、Al、S、Si |
| D、C、S、Mg |