题目内容
【题目】NaHSO3被用于棉织物和有机物漂白以及在染料、造纸、制革等工业中用作还原剂。
(1)NaHSO3可由NaOH溶液吸收SO2制得。
2NaOH(aq)+SO2(g)==Na2SO3(aq)+H2O(l) ΔH1
2NaHSO3(aq)==Na2SO3(aq)+SO2(g)+H2O(l) ΔH2
则反应SO2(g)+NaOH(aq)==NaHSO3(aq)的ΔH3=__________(用含ΔH1、ΔH2的代数式表示)。
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3 的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。
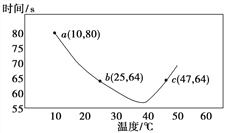
①a点时,v(NaHSO3)=__________mol·L-1·s-1。
②10~40℃区间内,显色时间越来越短,其原因是__________。
(3)已知:t℃时 H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;NaHSO3溶液pH<7。在t℃时,往NaOH溶液中通入SO2。
①在NaHSO3溶液中加入少量下列物质后,c(H2SO3)/c(HSO3-)的值增大的是______(填字母);
A.H2O B.稀H2SO4 C.H2O2溶液 D.NaOH溶液
②某时刻,测得溶液的pH=6,则此时,n(HSO3-)/n(SO32-)=_________;
③请画出从开始通入SO2直至过量时,溶液中n(SO32-)∶n(HSO3-)随pH的变化趋势图。_______
(4)以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的化学方程式_______________。
【答案】 ![]() 5.0×10-5 mol·L-1·s-1 升温反应速率加快,所以变色时间减短 BC 10
5.0×10-5 mol·L-1·s-1 升温反应速率加快,所以变色时间减短 BC 10 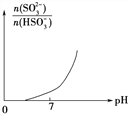 2HNO3+2H2O
2HNO3+2H2O![]() 2NH2OH+3O2↑
2NH2OH+3O2↑
【解析】(1)已知:
①2NaOH(aq)+SO2(g)==Na2SO3(aq)+H2O(l) ΔH1
②2NaHSO3(aq)==Na2SO3(aq)+SO2(g)+H2O(l) ΔH2
由盖斯定律:(①-②)/2得到反应SO2(g)+NaOH(aq)==NaHSO3(aq)的△H3=![]() ;
;
(2)①混合后NaHSO3的浓度为0.020molL-1×10/50=0.0040mol/L,反应所用时间为80min,则v=0.0040mol/L÷80min=5.0×10-5molL-1s-1;②升高温度反应速率加快,所以变色时间减小,即10~40℃时,温度升高,NaHSO3和KIO3反应的速率加快,显色时间减小;(3)①NaHSO3中存在水解平衡,其平衡常数为K=c(H2SO3)·c(OH-)/c(HSO3-),K为常数保持不变,则A.加H2O,溶液的pH增大,则c(OH-)增大,所以c(H2SO3)/c(HSO3-)的值减小,A错误;B.加稀H2SO4,溶液的pH减小,则c(OH-)减小,所以c(H2SO3)/c(HSO3-)的值增大,B正确;C.H2O2溶液与HSO3-反应生成NaHSO4,溶液的酸性增强,则c(OH-)减小,所以c(H2SO3)/c(HSO3-)的值增大,C正确;D.加NaOH溶液,溶液的pH增大,则c(OH-)增大,所以c(H2SO3)/c(HSO3-)的值减小,D错误;答案选BC;②NaHSO3中存在电离平衡HSO3-![]() SO32-+H+,亚硫酸的K2=c(SO32)c(H+)/c(HSO3)=1.0×10-7,则c(HSO3-)/c(SO32-)=1.0×106/1.0×107=10,所以n(HSO3-)/n(SO32-)=10;③往NaOH溶液中通入SO2至过量,溶液中发生的反应为:2NaOH+SO2=Na2SO3+H2O,Na2SO3+H2O+SO2=2NaHSO3,溶液中碱性越强,则SO32-的浓度越大,所以n(SO32-)∶n(HSO3-)随pH的增大而增大,其变化图为
SO32-+H+,亚硫酸的K2=c(SO32)c(H+)/c(HSO3)=1.0×10-7,则c(HSO3-)/c(SO32-)=1.0×106/1.0×107=10,所以n(HSO3-)/n(SO32-)=10;③往NaOH溶液中通入SO2至过量,溶液中发生的反应为:2NaOH+SO2=Na2SO3+H2O,Na2SO3+H2O+SO2=2NaHSO3,溶液中碱性越强,则SO32-的浓度越大,所以n(SO32-)∶n(HSO3-)随pH的增大而增大,其变化图为 。(4)在汞电极上NO3-可转化为NH2OH,氮元素化合价从+5价降低到-1价,得到电子,因此另一极应该是溶液中的氢氧根失去电子转化为氧气,所以该电解反应的化学方程式为2HNO3+2H2O
。(4)在汞电极上NO3-可转化为NH2OH,氮元素化合价从+5价降低到-1价,得到电子,因此另一极应该是溶液中的氢氧根失去电子转化为氧气,所以该电解反应的化学方程式为2HNO3+2H2O![]() 2NH2OH+3O2↑。
2NH2OH+3O2↑。

【题目】向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是
实验编号 | 1 | 2 | 3 | 4 | 5 |
BaCl2溶液体/ mL | 0 | 30 | 60 | 100 | 120 |
沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
A. 混合前,BaCl2溶液的物质的量浓度为0.05 mol/L
B. 混合前,Na2SO4溶液的物质的量浓度为0.30 mol/L
C. 实验3中沉淀的质量x为1.398g
D. 完全沉淀60mLNa2SO4溶液,消耗BaCl2溶液的体积为80mL