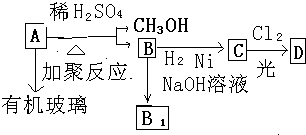
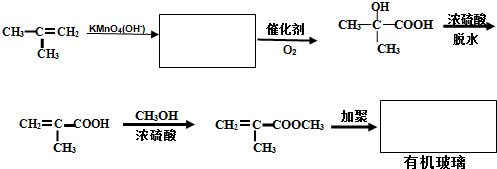
题目内容
19.下列说法正确的是( )| A. | 使用催化剂只是同倍数改变正逆反应速率,不会破坏化学平衡状态 | |
| B. | 95℃纯水的pH<7,说明水显酸性 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 氢气的标准燃烧热是-285.8 kJ•mol-1,则热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 |
分析 A、使用催化剂可以改变化学反应速率,但不能改变化学平衡状态;
B、纯水电离出的氢离子和氢氧根离子的浓度相等;
C、增大反应物浓度、增大压强,单位体积内活化分子数目增多,则反应速率加快;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物分析的热量;
解答 解:A、使用催化剂只是同倍数改变正逆反应速率,但平衡不移动,所以不能改变化学平衡状态,故A正确;
B、纯水电离出的氢离子和氢氧根离子的浓度相等,所以溶液呈中性,故B错误;
C、固体和纯液体加入反应物的量,但浓度不变,所以化学反应速率不一定增大,故C错误;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物分析,水生成的水不是稳定氧化物,应为液体,故D错误;
故选A.
点评 本题考查化学平衡移动知识的题目,燃烧热概念理解应用和外界条件改变对反应速率的影响,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,1.06gNa2CO3含有Na2CO3分子数为0.01NA个 | |
| B. | 标准状况下,22.4LCCl4含有的分子数为1NA个 | |
| C. | 通常状况下,NA个CO2分子占有的体积为22.4L | |
| D. | 0.5mol/L的MgCl2溶液和1mol/L的NaCl溶液中所含Cl-的物质的量浓度相等 |
10.既能跟盐酸反应又能跟氢氧化钠溶液反应的物质是( )
| A. | NH4Cl | B. | Al(OH)3 | C. | Na2CO3 | D. | AlCl3 |
7.下列化学用语使用正确的是( )
| A. | NH4Cl的电子式: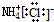 | |
| B. | 氯离子的结构示意图: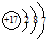 | |
| C. | 乙酸的结构简式:CH3COOH | |
| D. | 硫酸的电离方程式:H2SO4=H++SO42- |
14.X、Y、Z、W为短周期元素,且原子序数依次增大.已知X原子的最外层电子数是其内层电子数的3倍,Y原子最外层只有一个电子,Z是地壳中含量最高的金属元素,W与X属于同一主族.下列说法正确的是( )
| A. | 金属性:Z>Y | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 元素X和Y只能形成一种化合物 | |
| D. | Y、Z、W的最高价氧化物对应的水化物均能相互反应 |
11.下列事实或说法错误的是( )
| A. | 硅是制造太阳能电池的主要材料 | |
| B. | Na、K等金属着火了可用水或泡沫灭火器来灭火 | |
| C. | 漂白粉敞放在空气中容易变质,必须密闭、避光保存 | |
| D. | 铝既能跟稀硫酸、又能与烧碱溶液反应,且都产生氢气 |
8.有关Na2CO3和NaHCO3的叙述中正确的是( )
| A. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| B. | Na2CO3比NaHCO3不稳定 | |
| C. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| D. | Na2CO3和NaHCO3均可与NaOH溶液反应 |
9.下列有关物质用途的叙述不正确的是( )
| A. | 氧化铝是耐火耐高温材料 | B. | 硅用于光导纤维 | ||
| C. | 碳酸氢钠用于治疗胃酸过多 | D. | 铁红用于颜料 |
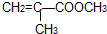 不溶于水,并可以发生以下变化:
不溶于水,并可以发生以下变化: