题目内容
6.将乙烯和氧气的混合气体,用电火花不断引燃,使乙烯完全燃烧(氧气过量).在120℃时测得反应后的混合气体对H2的相对密度是14.75.则原混合气体中乙烯和氧气的体积比为( )| A. | 1:3 | B. | 1:7 | C. | 1:1 | D. | 5:3 |
分析 发生反应:C2H4+3O2=2CO2+2H2O,120℃时水为气体,反应前后气体的物质的量不变,平均相对分子质量不变,由反应后的相对氢气的密度计算原混合气体中乙烯和氧气的平均相对分子质量,利用十字交叉法计算原混合气体中乙烯和氧气的体积比.
解答 解:120℃时燃烧生成的水为气态,氧气过量发生反应:C2H4+3O2=2CO2+2H2O,由方程式可知反应前后气体的物质的量不变,故平均相对分子质量不变,反应后气体密度为相同条件下H2密度的14.75倍,故原混合气体中乙烯和氧气的平均相对分子质量为14.75×2=29.5,根据十字交叉法: ,故原混合气体中乙烯和氧气的体积比为2.5:1.5=5:3,
,故原混合气体中乙烯和氧气的体积比为2.5:1.5=5:3,
故选D.
点评 本题考查混合物的计算,根据方程式的化学计量数判断反应前后混合气体的平均相对分子质量不变是关键,本题利用十字交叉法解答,注意理解.

练习册系列答案
相关题目
4.钠在空气中长期露置,最终变成( )
| A. | Na2O | B. | Na2O2 | C. | Na2CO3 | D. | NaOH |
14.向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:①H++OH-═H2O ②Al(OH)3+OH-═AlO2-+2H2O ③Al3++3OH-═Al(OH)3↓④NH4++OH-═NH3•H2O.发生反应的先后顺序正确的是( )
| A. | ①→④→③→② | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→②→③→④ |
1.如表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y是地壳中含量最高的元素.
请回答下列问题:
(1)X元素在周期表中的位置是第二周期VA族,Z元素的名称是硫.
(2)W、X、Y三种元素中,原子半径最大的是C;其氢化物中最稳定的是H2O,既含有极性共价键又含有非极性共价键的是H2O2 等.(任写一种,均写化学式)
(3)由W、Y和Z三种元素组成的化合物WYZ中,所有原子的最外层都满足8电子结构,写出该化合物的电子式: .
.
请回答下列问题:
| W | X | Y |
| Z |
(2)W、X、Y三种元素中,原子半径最大的是C;其氢化物中最稳定的是H2O,既含有极性共价键又含有非极性共价键的是H2O2 等.(任写一种,均写化学式)
(3)由W、Y和Z三种元素组成的化合物WYZ中,所有原子的最外层都满足8电子结构,写出该化合物的电子式:
 .
.
15.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含氧原子数为2NA |
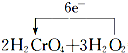 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O. A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.已知:F的原子序数为29,其余均为短周 期主族元素;E原子价电子(外围电子)排布式为 msnmpn-1;D原子的最外层电子数为偶数;A、C原子 的P轨道上都有两个未成对电子.请回答下列问题: