题目内容
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,应用电解实验可以制得白色的纯净的Fe(OH)2沉淀。两电极材料分别为石墨和铁。 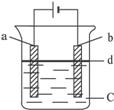
图6-28
(1)a电极材料应为____________,电极反应式为_________________。
(2)电解液C可以(填编号)是_____________。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是___________,在加入苯之前对C应作何简单处理________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是(填编号)___________。
A.改用稀硫酸作电解液 B.适当增大电源的电压
C.适当减小两电极间的距离 D.适当降低电解液的温度
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一现象是_______________________________。
解析:(1)电解法制Fe(OH)2,应让Fe失去电子变成Fe2+,H+得电子生成H2,从而使溶液碱性增强而生成Fe(OH)2,故铁应作阳极,与电源的正极相连;
(2)电解液中的离子浓度大,能加快速度,但D中的Cu2+比H+易得电子;
(3)苯的作用是防止空气中的O2溶于溶液中;
(5)反接电源电解时OH-就会放电产生O2。
答案:(1)铁 Fe-2e-====Fe2+
(2)BC
(3)防止空气中的O2溶于溶液中 加热煮沸以赶尽空气
(4)BC
(5)白色沉淀逐渐转变成红褐色。





