题目内容
3.对可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,下列图象正确的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 A.如只增加氧气的浓度,则正反应增大,且正反应速率大于逆反应速率,平衡向正反应方向移动;
B.正反应为放热反应,则升高温度平衡向逆反应方向移动;
C.对于可逆反应:2SO2(g)+O2(g)?2SO3(g)△H<0,应反应物气体的计量数之和大于生成物气体的化学计量数,增大压强平衡向正反应方向移动;
D.催化剂对平衡移动无影响,但改变反应速率.
解答 解:A.只增加氧气的浓度,则正反应增大,且正反应速率大于逆反应速率,平衡向正反应方向移动,与图象吻合,故A正确;
B.正反应为放热反应,则升高温度平衡向逆反应方向移动,二氧化硫的转化率降低,图象不符,故B错误;
C.增大压强,反应速率增大,到达平衡所用时间较少,图象不符,故C错误;
D.加入催化剂,反应速率增大,到达平衡所用时间较少,但平衡不移动,图象不符,故D错误;
故选A.
点评 本题以图象题的形成考查外界条件对化学平衡的影响,题目难度中等,注意根据反应的化学方程式判断,为解答该题的关键.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
13.二氧化碳气体中含有少量氯化氢杂质,若要除杂,最好选用( )
| A. | 饱和碳酸钠溶液 | B. | 浓硫酸 | ||
| C. | 饱和碳酸氢钠溶液 | D. | 饱和石灰水 |
11.下列热化学方程式或离子方程式中,正确的是( )
| A. | 向溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中,充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
18.常温下,最适宜薄荷生长的土壤pH≈8,土壤中的c(OH-)最接近于( )
| A. | 1×10-5mol/L | B. | 1×10-6mol/L | C. | 1×10-8mol/L | D. | 1×10-9molL |
8.已知反应:2NO2(红棕色)?N2O4(无色),分别进行如下两个实验:下列说法不正确的是( )
实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

实验i:将NO2球分别浸泡在热水和冰水中,现象如图1.
实验ii:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)如图2.

| A. | 图1现象说明该反应为放热反应 | |
| B. | 图2中b点的操作是压缩注射器 | |
| C. | c点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c) |
1.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 今年我国雾霾天气比较严重,雾霾属于气溶胶 | |
| B. | 煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 可以利用盐析和变性来分离、提纯蛋白质 |
2.下列实验操作或原理不正确的是( )
| A. | 纸层析法中滤纸所吸附的水作固定相,不与水混溶的有机溶剂作流动相 | |
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
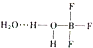 硼元素在化学中很重要的地位,硼及其化合物广泛应用于水磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.
硼元素在化学中很重要的地位,硼及其化合物广泛应用于水磁材料、超导材料、富燃料材料、复合材料等高新材料领域应用.